
Vad är en isotermisk process? (Exempel, övningar)
De isotermisk process eller isotermisk är en reversibel termodynamisk process där temperaturen förblir konstant. I en gas finns det situationer där en förändring i systemet inte ger temperaturvariationer utan fysiska egenskaper..
Dessa förändringar är fasförändringarna, när ämnet ändras från fast till flytande, från vätska till gas eller tvärtom. I sådana fall justerar ämnets molekyler sin position, tillsätter eller extraherar termisk energi..

Den termiska energi som krävs för en fasförändring i ett ämne kallas latent värme eller transformationsvärme.
Ett sätt att göra en process isotermisk är att sätta ämnet som kommer att undersökas i kontakt med en extern termisk behållare, vilket är ett annat system med hög kalorikapacitet. På detta sätt inträffar ett så långsamt värmeväxling att temperaturen förblir konstant..
Denna typ av process förekommer ofta i naturen. Till exempel hos människor, när kroppstemperaturen stiger eller sjunker, känner vi oss sjuka, för i vår kropp äger många kemiska reaktioner som upprätthåller livet en konstant temperatur. Detta gäller generellt för varmblodiga djur..
Andra exempel är is som smälter i värmen när våren kommer och isbitar som kyler drycken..
Artikelindex
- 1 Exempel på isotermiska processer
- 1.1 Carnot-cykeln
- 2 Beräkning av arbetet i en isotermisk process
- 2.1 - Övning 1
- 2.2 - Övning 2
- 3 Referenser
Exempel på isotermiska processer
-Metabolismen hos varmblodiga djur sker vid konstant temperatur.

-När vattnet kokar inträffar en fasförändring, från vätska till gas, och temperaturen förblir konstant vid cirka 100 ° C, eftersom andra faktorer kan påverka värdet.
-Att smälta is är en annan vanlig isotermisk process, liksom att placera vatten i frysen för att göra isbitar..
-Bilmotorer, kylskåp och många andra typer av maskiner fungerar korrekt i ett visst temperaturintervall. Enheter anropade termostater. Olika driftsprinciper används i dess design.
Carnot-cykeln
En Carnot-motor är en idealisk maskin från vilken man får arbete tack vare helt reversibla processer. Det är en idealisk maskin eftersom den inte tar hänsyn till processer som sprider energi, såsom viskositeten hos det ämne som utför arbetet eller friktion.
Carnot-cykeln består av fyra steg, varav två är exakt isotermiska och de andra två är adiabatiska. Isotermiska steg är kompression och expansion av en gas som är ansvarig för att producera användbart arbete.
En bilmotor fungerar på liknande principer. Rörelsen av en kolv inuti cylindern överförs till andra delar av bilen och ger rörelse. Det har inte beteendet hos ett idealiskt system som Carnot-motorn, men termodynamiska principer är vanliga.
Beräkning av arbetet i en isotermisk process
För att beräkna det arbete som utförts av ett system när temperaturen är konstant, måste man använda termodynamikens första lag, som säger:
ΔU = Q - W
Detta är ett annat sätt att uttrycka bevarande av energi i systemet, presenterat genom UU eller förändring i energi, F som levererad värme och slutligen W, vad är det arbete som utförs av nämnda system.
Antag att systemet i fråga är en idealisk gas som finns i cylindern i en rörlig kolv av området TILL, som fungerar när dess volym V ändring av V1 till Vtvå.

Den ideala gasekvationen för tillståndet är PV = nRT, som relaterar volym till tryck P och temperaturen T. Värdena för n och R är konstanta: n är antalet mol av gasen och R konstanten för gaserna. Vid en isotermisk process produkten PV det är konstant.
Tja, det utförda arbetet beräknas genom att integrera ett litet differentiellt arbete, i vilket en kraft F producerar en liten offset dx:
dW = Fdx = PAdx
Vad Adx är exakt variationen i volymen dV, sedan:
dW = PdV
För att få det totala arbetet i en isotermisk process integrerar vi uttrycket för dW:
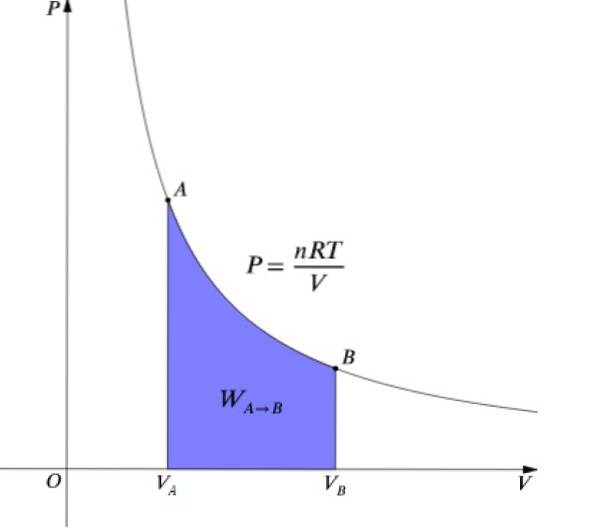
Trycket P och volymen V är ritade i ett diagram P-V som visas i figuren och det utförda arbetet är lika med arean under kurvan:

Vad AU = 0 eftersom temperaturen förblir konstant måste man i en isotermisk process:
Q = W
- Övning 1
En cylinder utrustad med en rörlig kolv innehåller en idealisk gas vid 127 ºC. Om kolven rör sig för att minska den initiala volymen tio gånger och hålla temperaturen konstant, hitta antalet mol gas som finns i cylindern, om arbetet på gasen är 38 180 J.
Faktum: R = 8,3 J / mol. K
Lösning
Uttalandet säger att temperaturen förblir konstant, därför är vi i närvaro av en isotermisk process. För arbetet på gasen har vi den tidigare härledda ekvationen:

127 º C = 127 + 273 K = 400 K
Lös för n, antalet mol:
n = W / RT ln (V2 / V1) = -38 180 J / 8,3 J / mol. K x 400 K x ln (Vtvå/ 10Vtvå) = 5 mol
Arbetet föregicks av ett negativt tecken. Den uppmärksamma läsaren har märkt i föregående avsnitt att W definierades som "arbete utfört av systemet" och har ett + -tecken. Så "arbetet på systemet" har ett negativt tecken.
- Övning 2
Du har luft i en cylinder försedd med en kolv. Ursprungligen är det 0,4 m3 gas under tryck 100 kPa och 80 ° C temperatur. Luft komprimeras till 0,1 m3 se till att temperaturen inuti cylindern förblir konstant under processen.
Bestäm hur mycket arbete som utförs under denna process.
Lösning
Vi använder ekvationen för tidigare härledda arbeten, men antalet mol är okänt, vilket kan beräknas med den ideala gasekvationen:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = P1V1 / RT = 100000 Pa x 0,4 m3 / 8,3 J / mol. K x 353 K = 13,65 mol
W = n.R.T ln (Vtvå/ V1) = 13,65 mol x 8,3 J / mol. K x 353 K x ln (0,1 /0,4) = -55,442,26 J
Återigen indikerar det negativa tecknet att arbete gjordes på systemet, vilket alltid händer när gasen komprimeras.
Referenser
- Bauer, W. 2011. Fysik för teknik och vetenskap. Volym 1. Mc Graw Hill.
- Cengel, Y. 2012. Termodynamik. 7mamma Utgåva. Mcgraw hill.
- Figueroa, D. (2005). Serie: Fysik för vetenskap och teknik. Volym 4. Vätskor och termodynamik. Redigerad av Douglas Figueroa (USB).
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage Learning.
- Wikipedia. Isotermisk process. Återställd från: en.wikipedia.org.


Ingen har kommenterat den här artikeln än.