
Vad är en utspädd lösning? faktorer och exempel
A utspädd lösning eller omättadDet är en kemisk lösning som inte har nått den maximala koncentrationen av löst löst i ett lösningsmedel. Den ytterligare lösningen löses upp när den tillsätts till en utspädd lösning och kommer inte att uppträda i vattenfasen..
Ur fysikalisk-kemisk synvinkel betraktas en omättad lösning som ett tillstånd av dynamisk jämvikt där hastigheterna med vilka lösningsmedlet löser upp lösningen är större än hastigheten för omkristallisation..
Ett exempel på en utspädd lösning illustreras i figur 1. I figur 1.1, 1.2 och 1.3 finns det en konstant volym vatten i bägaren.
I figur 1.1 börjar processen där det lösta ämnet börjar lösa sig, representerat av de röda pilarna. I detta fall ses två faser, en vätska och en fast substans.
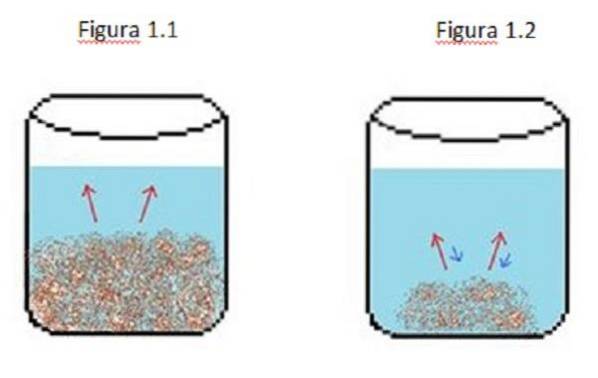
I figur 1.2 har mycket av det fasta ämnet lösts upp, men inte helt på grund av omkristalliseringsprocessen, representerad av de blå pilarna..
I detta fall är de röda pilarna större än de blå pilarna, vilket innebär att utspädningshastigheten är större än omkristallisationshastigheten. Vid denna tidpunkt har du en omättad lösning.
Således kan vi säga att en utspädd lösning kan lösa mer löst i den tills den når mättnadspunkten. Vid mättnadspunkten löses inget mer löst ämne i lösningsmedlet och en sådan lösning kallas en mättad lösning..
På detta sätt är lösningarna initialt omättade till sin natur och blir så småningom mättade lösningar genom tillsats av löst ämne i den..
Vad är en utspädd lösning?
En utspädd lösning är den omättade, mättade eller övermättade lösningen till vilken mer lösningsmedel tillsätts. Resultatet är en omättad lösning med lägre koncentration.
Utspädningar är en vanlig process i ett kemiskt laboratorium. I allmänhet arbetar du med utspädda lösningar som är gjorda av lagerlösningar som är de som köps direkt från en viss handlare.
För att göra utspädningarna används formeln C1V1= CtvåVtvå där C är koncentrationen av lösningen, vanligtvis i termer av molaritet eller normalitet. V är volymen av lösningen i ml och termer 1 och 2 motsvarar de koncentrerade respektive utspädda lösningarna.
Faktorer som påverkar lösligheten
Mängden löst ämne som kan lösas i ett lösningsmedel beror på olika faktorer, bland dem är de viktigaste:
1- Temperatur
Lösligheten ökar med temperaturen. Till exempel kan mer salt lösas upp i varmt vatten än i kallt vatten..
Det kan dock finnas undantag, till exempel, gasernas löslighet i vatten minskar med ökande temperatur..
I det här fallet får de lösta molekylerna kinetisk energi när de värms upp, vilket underlättar deras flykt..
2- Tryck
Ökat tryck kan tvinga upplöst lösning. Detta används ofta för att lösa upp gaser i vätskor..
3- Kemisk sammansättning
Löslighetens och lösningsmedlets natur och närvaron av andra kemiska föreningar i lösningen påverkar lösligheten..
Till exempel kan mer socker lösas i vatten än salt i vatten. I detta fall sägs det att socker är mer lösligt.
Etanol och vatten är helt lösliga med varandra. I detta speciella fall kommer lösningsmedlet att vara den förening som finns i den största mängden.
4- Mekaniska faktorer
I motsats till upplösningshastigheten, som huvudsakligen beror på temperaturen, beror omkristallisationshastigheten på den lösta koncentrationen på ytan av kristallgitteret, vilket föredras när en lösning är orörlig.
Omröring av lösningen förhindrar därför denna ansamling, vilket maximerar upplösningen..
Mättnad och löslighetskurvor
Löslighetskurvorna är en grafisk databas där mängden löst ämne som löses i en mängd lösningsmedel jämförs vid en viss temperatur.
Löslighetskurvor plottas vanligtvis för en mängd löst ämne, antingen fast eller gas, i 100 gram vatten. Mättnadskurvor för olika lösta ämnen i vatten illustreras i figur 2..
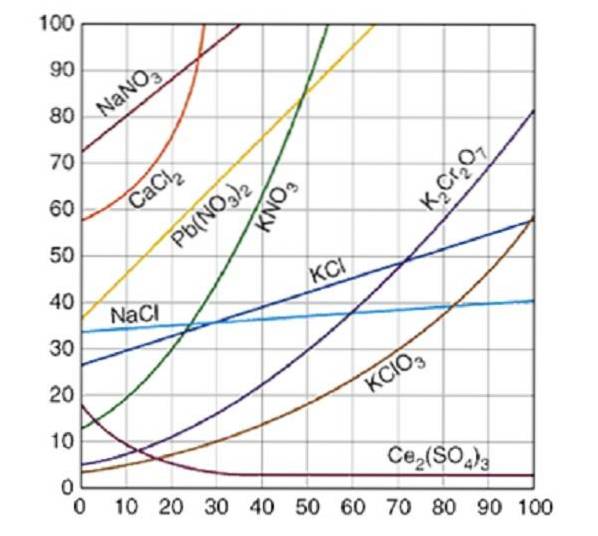
Kurvan anger mättnadspunkten vid en given temperatur. Området under kurvan indikerar att du har en omättad lösning och därför kan mer löst tillsättas. I området ovanför kurvan finns en övermättad lösning.
Ta natriumklorid (NaCl) som ett exempel, vid 25 grader Celsius kan cirka 35 gram NaCl lösas i 100 gram vatten för att erhålla en mättad lösning.
Exempel på utspädda lösningar
Omättade lösningar finns dagligen, det är inte nödvändigt att vara i kemikalielaboratorium.
Lösningsmedlet behöver inte nödvändigtvis vara vatten. Nedan följer vardagliga exempel på utspädda lösningar:
- Tillsätt en matsked socker till en kopp varmt kaffe ger en omättad sockerlösning.
- Vinäger är en utspädd lösning av ättiksyra i vatten.
- Dimma är en omättad (men nära mättad) lösning av vattenånga i luften.
- 0,01 M HCl är en omättad lösning av saltsyra i vatten.
- Gnugga alkohol är en utspädd lösning av isopropylalkohol i vatten.
- Soppan är en omättad lösning av vatten och natriumklorid.
- Alkoholhaltiga drycker är utspädda lösningar av etanol och vatten. Vanligtvis visas procentandelen alkohol som de har.
Referenser
- Anne Marie Helmenstine, P. (2016, 7 juli). Mättad lösning Definition och exempel. Återställd från about.com.
- Cambrige University. (s.f.). Löslighetskurvor. Återställd från dynamicscience.com.au.
- Exempel på mättad lösning. (s.f.). Återställd från exempel.yourdcitionary.com.
- J., S. (2014, 4 juni). Mättade och övermättade lösningar. Återställd från socratic.org.
- James, N. (s.f.). Mättad lösning: Definition och exempel. Återställd från study.com.
- M., B. (2014, 14 oktober). Mättade och övermättade lösningar. Återställd från socratic.org.
- Löslighetskurvor. (s.f.). Återställd från kentchemistry.com.
- Mättningsrör. (2014, 26 juni). Återställd från chem.libretexts.org.
Ingen har kommenterat den här artikeln än.