
Diazoniumsalter Formation, egenskaper och applikationer
De diazoniumsalter är organiska föreningar i vilka det finns joniska interaktioner mellan azogruppen (-Ntvå+) och en anjon X- (Cl-, F-, CH3KUTTRA-, etc.). Dess allmänna kemiska formel är RNtvå+X-, och i detta kan sidokedjan R mycket väl vara en alifatisk grupp eller en arylgrupp; dvs. en aromatisk ring.
Den nedre bilden representerar arenediazoniumstrukturen. De blå sfärerna motsvarar azogruppen, medan de svarta och vita sfärerna utgör den aromatiska ringen av fenylgruppen. Azogruppen är mycket instabil och reaktiv, eftersom en av kväveatomerna har en positiv laddning (-N+≡N).
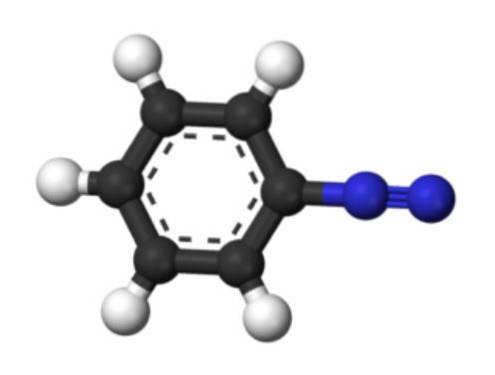
Det finns emellertid resonansstrukturer som avlägsnar denna positiva laddning, till exempel på den angränsande kväveatomen: -N = N+. Detta har sitt ursprung när ett par elektroner som bildar en bindning går till kväveatomen till vänster.
På samma sätt kan denna positiva laddning avlägsnas av Pi-systemet i den aromatiska ringen. Som en konsekvens är aromatiska diazoniumsalter mer stabila än alifatiska, eftersom den positiva laddningen inte kan avlägsnas längs en kolkedja (CH2).3, CHtvåCH3, etc.).
Artikelindex
- 1 Utbildning
- 2 fastigheter
- 2.1 Förskjutningsreaktioner
- 2.2 Andra förskjutningar
- 2.3 Redoxreaktioner
- 2.4 Fotokemisk nedbrytning
- 2.5 Azo-kopplingsreaktioner
- 3 applikationer
- 4 Referenser
Träning
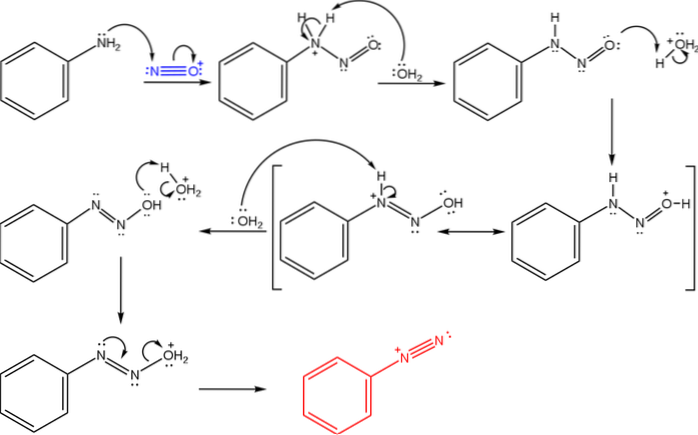
Dessa salter härrör från reaktionen mellan en primär amin och en syrablandning av natriumnitrit (NaNOtvå).
Sekundära aminer (RtvåNH) och tertiär (R3N) härstammar från andra kvävehaltiga produkter såsom N-nitrosoaminer (som är gulaktiga oljor), aminsalter (R3HN+X-) och N-nitrosoammoniumföreningar.
Den övre bilden illustrerar mekanismen genom vilken bildandet av diazoniumsalter regleras, eller även känd som diazotiseringsreaktionen.
Reaktionen börjar med fenylamin (Ar-NHtvå), som utför en nukleofil attack på N-atomen i nitrosoniumkatjonen (NO+). Denna katjon produceras av blandningen NaNOtvå/ HX, där X i allmänhet är Cl; dvs HCl.
Bildningen av nitrosoniumkatjonen släpper ut vatten i mediet, vilket tar bort en proton från det positivt laddade kvävet..
Sedan samma vattenmolekyl (eller en annan sur art än H3ELLER+) ger en proton till syre, avlägsnar den positiva laddningen på den mindre elektronegativa kväveatomen).
Nu deprotonerar vattnet kvävet igen och producerar därmed diazohydroxidmolekylen (den näst sista i sekvensen).
Eftersom mediet är surt, genomgår diazohydroxiden dehydrering från OH-gruppen; för att motverka elektronisk vakans bildar det fria paret N tri-bindningen av azogruppen.
Således, i slutet av mekanismen, har bensenediazoniumklorid (C6H5Ntvå+Cl-, samma katjon från den första bilden).
Egenskaper
I allmänhet är diazoniumsalter färglösa och kristallina, lösliga och stabila vid låga temperaturer (mindre än 5 ºC)..
Några av dessa salter är så känsliga för mekanisk påverkan att någon fysisk manipulation kan detonera dem. Slutligen reagerar de med vatten för att bilda fenoler.
Förskjutningsreaktioner
Diazoniumsalter är potentiella frigörare av molekylärt kväve, vars bildning är den gemensamma nämnaren i deplacementreaktioner. I dessa förskjuter en art X den instabila azogruppen och flyr som Ntvå(g).
Sandmeyer-reaktion
ArNtvå+ + CuCl => ArCl + Ntvå + Cu+
ArNtvå+ + CuCN => ArCN + Ntvå + Cu+
Gatterman-reaktion
ArNtvå+ + CuX => ArX + Ntvå + Cu+
Till skillnad från Sandmeyer-reaktionen har Gatterman-reaktionen metallisk koppar istället för halogeniden; det vill säga CuX genereras in situ.
Schiemanns reaktion
[ArNtvå+] BF4- => ArF + BF3 + Ntvå
Schiemann-reaktionen kännetecknas av termisk nedbrytning av bensenediazoniumfluorborat.
Gomberg Bachmann-reaktion
[ArNtvå+] Cl- + C6H6 => Ar - C6H5 + Ntvå + HCl
Andra förskjutningar
ArNtvå+ + KI => ArI + K+ + Ntvå
[ArNtvå+] Cl- + H3POtvå + HtvåO => C6H6 + Ntvå + H3PO3 + HCl
ArNtvå+ + HtvåO => ArOH + Ntvå + H+
ArNtvå+ + Stämpeltvå => ArNOtvå + Ntvå + Cu+
Redoxreaktioner
Diazoniumsalter kan reduceras till arylhydraziner med en blandning av SnCltvå/ HCl:
ArNtvå+ => ArNHNHtvå
De kan också reduceras till arylaminer i starkare minskningar med Zn / HCl:
ArNtvå+ => ArNHtvå + NH4Cl
Fotokemisk nedbrytning
[ArNtvå+] X- => ArX + Ntvå
Diazoniumsalter är känsliga för sönderdelning genom förekomst av ultraviolett strålning eller vid mycket nära våglängder.
Azo-kopplingsreaktioner
ArNtvå+ + Ar'H → ArNtvåAr '+ H+
Dessa reaktioner är kanske den mest användbara och mångsidiga av diazoniumsalterna. Dessa salter är svaga elektrofiler (ringen avlägsnar den positiva laddningen i azogruppen). För att de ska kunna reagera med aromatiska föreningar måste de laddas negativt, vilket ger upphov till azoföreningar..
Reaktionen äger rum med ett effektivt utbyte mellan ett pH av 5 och 7. Vid surt pH är kopplingen lägre eftersom azogruppen är protonerad, vilket gör det omöjligt att angripa den negativa ringen..
På samma sätt reagerar diazoniumsaltet i basiskt pH (större än 10) med OH- för att producera diazohydroxid, som är relativt inert.
Strukturer av denna typ av organisk förening har ett mycket stabilt konjugerat Pi-system, vars elektroner absorberar och avger strålning i det synliga spektrumet..
Följaktligen kännetecknas azoföreningar av att vara färgglada. På grund av denna egenskap har de också kallats azofärger.
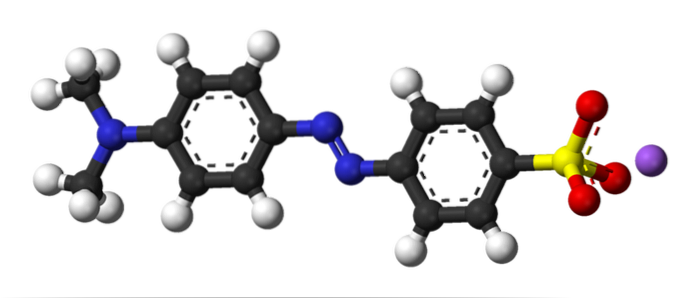
Bilden ovan illustrerar begreppet azokoppling med metylorange som ett exempel. I mitten av sin struktur kan azogruppen ses som en kontakt för de två aromatiska ringarna.
Vilken av de två ringarna var elektrofilen i början av kopplingen? Den till höger, eftersom sulfonatgruppen (-SO3) tar bort elektrontätheten från ringen, vilket gör den ännu mer elektrofil.
Applikationer

En av dess mest kommersiella tillämpningar är produktionen av färgämnen och pigment, vilket även omfattar textilindustrin vid färgning av tyger. Dessa azoföreningar förankras till specifika molekylära platser på polymeren och färgar den i färger.
På grund av dess fotolytiska sönderdelning används den (mindre än tidigare) vid återgivning av dokument. Hur? Områdena på papperet som täcks av en speciell plast tas bort och sedan appliceras en grundläggande lösning av fenol på dem, som färgar bokstäverna eller designen blå..
I organiska synteser används de som utgångspunkter för många aromatiska derivat.
Slutligen har de applikationer inom smarta material. I dessa är de kovalent bundna till en yta (till exempel guld), vilket gör det möjligt att ge ett kemiskt svar på yttre fysiska stimuli..
Referenser
- Wikipedia. (2018). Diazoniumförening. Hämtad den 25 april 2018 från: en.wikipedia.org
- Francis A. Carey. Organisk kemi. Karboxylsyror. (sjätte upplagan, sidorna 951-959). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Aminer. (10: e upplagan, sidorna 935-940). Wiley plus.
- Clark J. (2016). Reaktioner av diazoniumsalter. Hämtad den 25 april 2018 från: chemguide.co.uk
- BYJU'S. (05 oktober 2016). Diazoniumsalter och deras tillämpningar. Hämtad den 25 april 2018 från: byjus.com
- TheGlobalTutors. (2008-2015). Egenskaper för diazoniumsalter. Hämtad den 25 april 2018 från: theglobaltutors.com
- Ahmad et al. (2015). Polymer. Hämtad den 25 april 2018 från: msc.univ-paris-diderot.fr
- CytokromT. (15 april 2017). Mekanism för bildandet av benzenediazoniumjonen. Hämtad den 25 april 2018 från: commons.wikimedia.org
- Jacques Kagan. (1993). Organisk fotokemi: principer och tillämpningar. Academic Press Limited, sidan 71. Hämtad den 25 april 2018 från: books.google.co.ve



Ingen har kommenterat den här artikeln än.