
Förtvålningsreaktion och erhållbara ämnen

De förtvålning är den grundläggande hydrolysen av en ester. Detta innebär att estern reagerar med en bas (NaOH eller KOH) irreversibelt och producerar alkohol och natrium- eller kaliumkarboxylater. Ordet betyder "tvåltillverkning" och i själva verket är det en av de äldsta kemiska reaktionerna som används av mänskligheten..
I babylonisk tid, med hjälp av aska som samlats från trä och växter och animaliska fetter, gjorde de tvåltillverkningskonsten. Varför animaliskt fett? Anledningen är att den är rik på glycerol-triestrar (triglycerider) och träaska är en kaliumkälla, den grundläggande metallen.
Annars fortsätter reaktionen med ett lägre utbyte, men tillräckligt för att återspegla dess effekter på färger och vissa ytor. Så är fallet med oljefärger, där pigmenten blandas med olja (esterkälla).
Artikelindex
- 1 Förtvålningsreaktion
- 1.1 Mekanism
- 1.2 Kinetik
- 2 Ämnen som kan erhållas genom förtvålning
- 2.1 Lösningsmedel av tvålar
- 3 Referenser
Förtvålningsreaktion
Mekanism
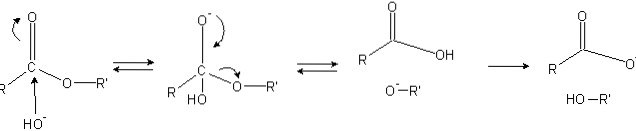
Estrar har en acylgrupp (O = C-R), som är känslig för nukleofila attacker såsom OH-.
Eftersom syreatomerna "stjäl" elektrontätheten från kolatomen är den delvis positivt laddad, ännu mer i fallet med estrar.
Följaktligen lockar denna positiva laddning negativa arter som kan bidra med elektroner till kolatomen, vilket orsakar nukleofil attack (bildens vänstra sida). Som ett resultat bildas en tetraedrisk mellanprodukt (den andra molekylen från vänster till höger).
Den negativa laddningen på syret i den tetraedriska mellanprodukten är produkten av en OH- omgivande. Denna negativa laddning delokaliseras sedan för att ge upphov till karbonylgruppen och "tvingar" sedan C-OR-bindningen att bryta. På samma sätt producerar denna delokalisering en karboxylsyra RCOOH och en alkoxidjon R'O-.
Slutligen, eftersom reaktionsmediet är basiskt, deprotonerar alkoxiden en vattenmolekyl och karboxylsyran reagerar med en annan OH.- mediet som genererar förtvålningsprodukterna.
Kinetik
Förtvålningsreaktionens hastighet är proportionell mot reagensens koncentrationer. Med andra ord ökar antingen koncentrationen av estern (RCOOR ') eller basen (NaOH) snabbare.
Detta översätts också enligt följande: förtvålningshastigheten är första ordningen i förhållande till estern och första ordningen i förhållande till basen. Ovanstående kan uttryckas med följande matematiska ekvation:
Hastighet = k [RCOOR '] [NaOH]
Där k är hastigheten konstant eller koefficient, som varierar beroende på temperatur eller tryck; det vill säga ju högre värme desto högre förtvålningshastighet. Av denna anledning kokas mediet.
Eftersom båda reaktanterna är av den första kinetiska ordningen är den totala reaktionen av andra ordningen.
I förtvålningsreaktionsmekanismen kräver bildandet av den tetraedriska mellanprodukten nukleofil attack, som involverar både estern och basen..
Andra ordningens kinetik återspeglas i detta faktum, eftersom de ingriper i det avgörande (långsamma) steget i reaktionen.
Ämnen som kan erhållas genom förtvålning

De viktigaste produkterna för förtvålning är alkoholer och salter av karboxylsyror. I ett surt medium erhålls respektive RCOOH, erhållet genom förtvålning av fetter och oljor, som är kända som fettsyror.
Således består tvålar av salter av fettsyrorna som produceras genom förtvålning. Kommer du ut med vilka katjoner? De kan vara Na+, K+, Mgtvå+, Tro3+, etc.
Dessa salter är lösliga i vatten men fälls ut genom inverkan av NaCl tillsatt till blandningen, vilket dehydratiserar tvålen och separerar den från den vattenhaltiga fasen. Förtvålningsreaktionen för en triglycerid är som följer:
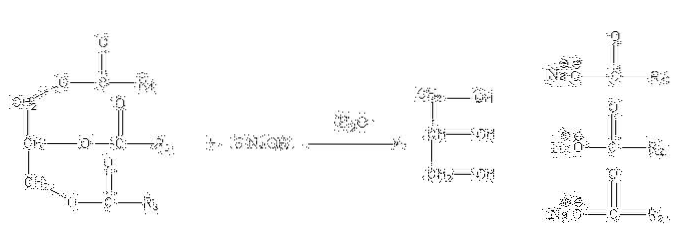
Glycerin är alkoholen "E" och tvål är alla salter av de resulterande fettsyrorna. Här har varje -R-sidokedja olika längder och grad av omättnad. Följaktligen gör dessa kedjor skillnad mellan vegetabiliska fetter och oljor.
Nyckeln till tillverkning av tvål ligger då i valet av de bästa fetterna och oljorna, eller mer specifikt, i valet av olika källor till triglycerider..
Denna tvålvita massa kan innehålla färgämnen och andra organiska föreningar i sin struktur, vilket ger den behagliga dofter och ljusa färger. Härifrån tämjas utbudet av möjligheter av konst och kallelse i denna bransch..
Förtvålningsreaktionen är emellertid också en syntetisk väg för karboxylsyror och alkoholer som inte nödvändigtvis har att göra med glycerol eller tvål..
Till exempel kommer basisk hydrolys av vilken som helst ester, såsom enkelt etylacetat, att producera ättiksyra och etanol..
Lösningsmedel av tvålar

Fettsyrasalter är lösliga i vatten, men inte på samma sätt som joner solvatiseras; det vill säga omgiven av en vattnig sfär. När det gäller tvålar förhindrar deras -R-sidokedjor teoretiskt att de löses upp i vatten.
För att motverka denna energiskt besvärliga position är de orienterade på ett sådant sätt att dessa kedjor kommer i kontakt och bildar en apolär organisk kärna, medan de polära huvuden, den extrema (-COO- Na+), interagera med vattenmolekyler och skapa ett "polärt skal".
Ovanstående illustreras i den övre bilden, där denna typ av struktur känd som en micell visas.
De "svarta svansarna" motsvarar de hydrofoba kedjorna, som trasslar sig in i en organisk kärna skyddad av de grå sfärerna. Dessa grå sfärer utgör polarkuirassen, -COO-huvuden- Na+.
Så miceller är kluster (tätorter) av fettsyrasalter. Inom dessa kan de innehålla fett, som är olösligt i vatten på grund av dess icke-polära karaktär..
Hur gör de det? Både fett- och -R-kedjor är hydrofoba, så båda har hög affinitet för varandra.
När micellerna omsluter fetterna samverkar vattnet med det polära skalet, vilket möjliggör tvålens löslighet. På samma sätt är micellerna negativt laddade, orsakar avstötningar mot varandra och genererar därför spridning av fett..
Referenser
- Anne Marie Helmenstine, Ph.D. (3 oktober 2017). Förtvålningsdefinition och reaktion. Hämtad den 24 april 2018 från: thoughtco.com
- Francis A. Carey. Organisk kemi. Karboxylsyror. (sjätte upplagan, sidorna 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Lipider (10: e upplagan., Sidor 1056-1058). Wiley plus.
- Wikipedia. (2018). Förtvålning. Hämtad den 24 april 2018 från: en.wikipedia.org
- Boyd C. (27 februari 2015). Förstå tvålens kemi och historia. Hämtad den 24 april 2018 från: chemservice.com
- Luca Laghi. (27 mars 2007). Förtvålning. Hämtad den 24 april 2018 från: commons.wikimedia.org
- Amanda Crochet. (12 maj 2015). Micelle (gråskala). Hämtad den 24 april 2018 från: commons.wikimedia.org


Ingen har kommenterat den här artikeln än.