
Selenhistoria, egenskaper, struktur, erhållande, användningar
De selen Det är ett icke-metalliskt kemiskt grundämne som tillhör grupp 16 i det periodiska systemet och representeras av symbolen Se. Detta element har mellanegenskaper mellan svavel och tellur, som är medlemmar i samma grupp.
Selen upptäcktes 1817 av Jöhs J. Berzelius och John G. Gahn, som vid förångning av pyriten observerade en röd rest (lägre bild). Först förväxlade de det med tellur, men insåg sedan att de hade att göra med ett nytt element.

Berzelius namngav det nya elementet selen, baserat på namnet "selene" som betyder "gudinnan av månen." Selen är ett viktigt spårämne för växter och djur, men i höga koncentrationer är det ett giftigt element.
Selen har tre huvudsakliga allotropa former: rött, svart och grått. Den senare har egenskapen att modifiera sin elektriska konduktans beroende på ljusintensiteten som strålar ut den (fotoledare), för vilken den har haft många applikationer.
Selen distribueras i stor utsträckning i jordskorpan, men mineralerna som innehåller den är inte rikliga, så det finns ingen brytning av selen.
Det erhålls främst som en biprodukt av kopparelektrolysförädlingsprocessen. Selen ackumuleras i slammet som finns vid anoden i elektrolyscellerna.
Människor har cirka 25 selenoproteiner, varav några har en antioxidantverkan och kontrollerar alstringen av fria radikaler. Det finns också aminosyror av selen, såsom selenometionin och selenocystein.
Artikelindex
- 1 Historia
- 1.1 Första observationen
- 1.2 Upptäckt
- 1.3 Namnets ursprung
- 1.4 Utveckla dina applikationer
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Utseende
- 2.2 Standard atomvikt
- 2.3 Atomnummer (Z)
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Fusionsvärme
- 2.8 Förångningsvärme
- 2.9 Molär värmekapacitet
- 2.10 oxidationsnummer
- 2.11 Elektronegativitet
- 2.12 Joniseringsenergi
- 2.13 Magnetisk ordning
- 2.14 Hårdhet
- 2.15 Isotoper
- 2.16 Allotropi
- 3 Reaktivitet
- 3.1 Reaktion med väte
- 3.2 Reaktion med syre
- 3.3 Reaktion med halogener
- 3.4 Reaktion med metaller
- 3,5 seleniter
- 3.6 Syror
- 4 Struktur och elektronisk konfiguration
- 4.1 - Selen och dess obligationer
- 4.2 - Ringar eller kedjor
- 4.3 - Allotropes
- 5 Var man kan hitta och producera
- 5.1 Elektrolys av koppar
- 6 Biologisk roll
- 6.1 Brist
- 6.2 Enzymkofaktor
- 6.3 Proteiner och aminosyror
- 7 risker
- 8 användningsområden
- 8.1 Kosmetika
- 8.2 Läkare
- 8.3 Elektrolys av mangan
- 8.4 Pigment
- 8.5 Fotoledare
- 8.6 Kristaller
- 8.7 Vulkanisering
- 8.8 Legeringar
- 8.9 Likriktare
- 9 Referenser
Berättelse
Första observationen
Alkemisten Arnold de Villanova kan ha observerat selen 1230. Han utbildade sig i medicin vid Sorbonne i Paris och var till och med läkare till påven Clement V.
Villanova i sin bok Rosarium Philosophorum beskriver ett rött svavel eller "svavel rebeum" som hade lämnats i en ugn efter förångning av svavlet. Detta röda svavel kan ha varit en allotrop av selen.
Upptäckt
1817 upptäckte Jöhs Jakob Berzelius och John Gottlieb Gahn selen i en kemisk anläggning för produktion av svavelsyra, nära Gripsholm, Sverige. Råmaterialet för att tillverka syran var pyrit, som extraherades från en Falun-gruva..
Berzelius slogs av förekomsten av en röd rest som förblev i blybehållaren efter att svavlet hade bränts.
Berzelius och Gahn observerade också att den röda återstoden hade en stark pepparrotslukt, liknande den för tellur. Därför skrev han till sin vän Marect att de trodde att den observerade fyndigheten var en tellurförening..
Berselius fortsatte dock att analysera det material som deponerades när pyriten förbränts och omprövade att inget tellur hade hittats i Falun-gruvan. Han konstaterade i februari 1818 att han hade upptäckt ett nytt element.
Namnets ursprung
Berzelius påpekade att det nya grundämnet var en kombination av svavel och tellur, och att likheten mellan tellur och det nya elementet hade gett honom möjlighet att namnge den nya substansen selen..
Berzelius förklarade att "tellus" betyder jordens gudinna. Martin Klaport gav 1799 detta namn till tellurium och skrev: ”Inget enda element kallas det. Det måste göras! ".
På grund av likheten mellan tellur och den nya substansen namngav Berzelius det med ordet selen, härledt från det grekiska ordet "selene" som betyder "gudinna av månen.".
Utveckling av dina applikationer
1873 upptäckte Willoughby Smith att den elektriska ledningsförmågan hos selen berodde på ljuset som utstrålade det. Den här egenskapen tillät selen att ha många applikationer.
Alexander Graham Bell 1979 använde selen i sin fototelefon. Selen producerar en elektrisk ström som är proportionell mot ljusets intensitet som lyser upp den, används i ljusmätare, säkerhetsmekanismer för att öppna och stänga dörrar etc..
Användningen av selenlikriktare i elektronik började på 1930-talet med många kommersiella applikationer. På 1970-talet ersattes det i likriktare av kisel.
1957 upptäcktes att selen var ett viktigt element för däggdjurens liv, eftersom det fanns i enzymer som skyddar mot reaktivt syre och fria radikaler. Dessutom upptäcktes förekomsten av aminosyror såsom selenometionin.
Fysiska och kemiska egenskaper
Utseende
Eftersom det finns flera allotroper för selen varierar dess fysiska utseende. Uppträder vanligtvis som ett rödaktigt fast ämne i pulverform.
Standard atomvikt
78,971 u
Atomnummer (Z)
3. 4
Smältpunkt
221 ºC
Kokpunkt
685 ºC
Densitet
Densiteten av selen varierar beroende på vilken allotrop eller polymorf som anses. Några av dess densiteter bestämda vid rumstemperatur är:
Grå: 4,819 g / cm3
Alfa: 4,39 g / cm3
Glasögon: 4,28 g / cm3
Flytande tillstånd (smältpunkt): 3,99 g / cm3
Fusionsvärme
Grå: 6,69 kJ / mol
Förångningsvärme
95,48 kJ / mol
Molär värmekapacitet
25,363 J / (mol K)
Oxidationsnummer
Selen kan binda i sina föreningar som manifesterar följande siffror eller oxidationstillstånd: -2, -1, +1, +2, +3, +4, +5, +6. Bland dem alla är de viktigaste -2 (Setvå-), +4 (Se4+) och +6 (Se6+).
Till exempel i SeOtvå selen har ett oxidationsnummer på +4; det vill säga att katjonen Se antas4+ (Jag vet4+ELLERtvåtvå-). På samma sätt med SeO3 selen har ett oxidationsnummer på +6 (Se6+ELLER3två-).
I väteselenid, HtvåSe, selen har ett oxidationsnummer på -2; det är, återigen, förekomsten av jonen eller anjonen Se antastvå- (Htvå+jag vettvå-). Detta beror på att selen är mer elektronegativt än väte..
Elektronnegativitet
2,55 på Pauling-skalan.
Joniseringsenergi
-Först: 941 kJ / mol.
-Andra: 2045 kJ / mol.
-Tredje: 2 973,7 kJ / mol.
Magnetisk ordning
Diamagnetisk.
Hårdhet
2.0 på Mohs-skalan.
Isotoper
Det finns fem naturliga och stabila isotoper av selen, som visas nedan med deras respektive överflöd:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropi

Selen framställt i kemiska reaktioner är ett tegelrött amorft pulver som, när det snabbt smälter, ger upphov till den glaskroppsform, som liknar radbandspärlor (toppbild). Black Selenium är en spröd och blank fast substans.
Dessutom är svart selen något lösligt i kolsulfid. När denna lösning värms upp till 180 ° C, faller grå selen ut, den är den mest stabila och täta allotropen..
Grått selen är resistent mot oxidation och är inert mot verkan av icke-oxiderande syror. Huvudegenskapen för detta selen är dess fotokonduktivitet. När den är upplyst ökar dess elektriska ledningsförmåga med en faktor 10 till 15 gånger.
Reaktivitet
Selen i dess föreningar finns i oxidationstillstånden -2, +4 och +6. Det visar en tydlig tendens att bilda syror i högre oxidationstillstånd. Föreningar som har selen med oxidationstillstånd -2 kallas selenider (Setvå-).
Reaktion med väte
Selen reagerar med väte för att bilda väteselenid (HtvåSe), en färglös, brandfarlig och illaluktande gas.
Reaktion med syre
Selen brinner med blå flamma och bildar selen:
jag vet8 (s) + 8 Otvå => 8 SeOtvå (s)
Selenoxid är en fast, vit, polymer substans. Dess hydratisering ger selenious syra (HtvåSeO3). Selen bildar också selentrioxid (SeO3), analogt med svavel (SO3).
Reaktion med halogener
Selen reagerar med fluor och bildar selenhexafluorid:
jag vet8 (s) + 24 Ftvå (g) => 8 SeF6 (l)
Selen reagerar med klor och brom för att bilda disileniumdiklorid respektive dibromid:
jag vet8 (s) + 4 Cltvå => 4 SetvåCltvå
jag vet8 (s) + 4 Brtvå => 4 SetvåBrtvå
Selen kan också bilda SeF4 och SeCl4.
Å andra sidan bildar selen föreningar i vilka en selenatom förenas med en av halogen och en annan av syre. Ett viktigt exempel är selenoxiklorid (SeOtvåCltvå), med selen i oxidationstillstånd +6, ett extremt kraftfullt lösningsmedel.
Reaktion med metaller
Selen reagerar med metaller för att bilda selenider av aluminium, kadmium och natrium. Den kemiska ekvationen nedan motsvarar den för bildandet av aluminiumselenid:
3 Se8 + 16 Al => 8 Altvåjag vet3
Seleniter
Selen bildar salter som kallas seleniter; till exempel: silver selenit (AgtvåSeO3och natriumselenit (NatvåSeO3). Detta namn har använts i litterära sammanhang för att hänvisa till månens invånare: Seleniterna.
Syror
Den viktigaste syran i selen är seleninsyra (HtvåSeO4). Den är lika stark som svavelsyra och minskar lättare.
Struktur och elektronisk konfiguration
- Selen och dess länkar
Selen har sex valenselektroner, varför det ligger i grupp 16, detsamma som syre och svavel. Dessa sex elektroner är i 4s och 4p orbitaler, enligt deras elektroniska konfiguration:
[Ar] 3d10 4stvå 4p4
Det behöver därför, som svavel, att bilda två kovalenta bindningar för att slutföra sin valensoktet; även om den har tillgång till sina 4d-orbitaler för att binda med mer än två atomer. Således kommer tre selenatomer samman och bildar två kovalenta bindningar: Se-Se-Se.
Selen med sin högsta atommassa har en naturlig tendens att bilda strukturer som styrs av kovalenta bindningar; istället för att ordnas som diatomiska molekyler Setvå, Se = Se, analogt med Otvå, O = O.
- Ringar eller kedjor
Bland de molekylära strukturer som selenatomer antar kan två nämnas i allmänna termer: ringar eller kedjor. Observera att i det hypotetiska fallet Se3, Se-atomerna i ändarna kräver fortfarande elektroner; därför måste de vara bundna till andra atomer i följd tills kedjan kan stängas i en ring.
De vanligaste ringarna är de åtta ledade ringarna eller selenatomerna:8 (en selenitkrona). Varför åtta? Eftersom ju mindre ringen desto mer stress kommer den att drabbas; det vill säga vinklarna på deras bindningar avviker från de naturliga värden som ställs in av deras SP-hybridiseringar3 (liknande som förekommer med cykloalkaner).
Eftersom det finns åtta atomer är separationen mellan Se-Se-atomerna tillräcklig så att deras bindningar är "avslappnade" och inte "böjda"; även om länkens vinkel är 105,7 º och inte 109,5 º. Å andra sidan kan det finnas mindre ringar:6 och7.
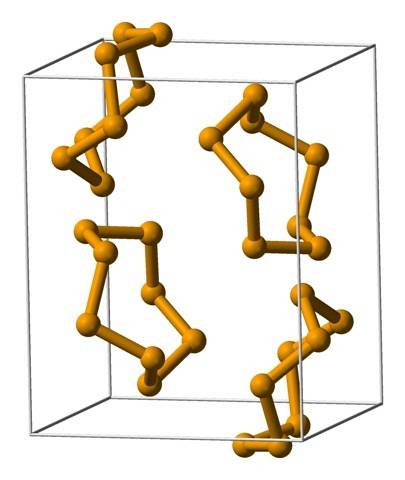
Den översta bilden visar Se ring-enheterna.8. Notera likheten med svavelkronorna; bara de är större och tyngre.
Förutom ringar kan selenatomer också ordnas i spiralformiga kedjor (tänk spiraltrappor):
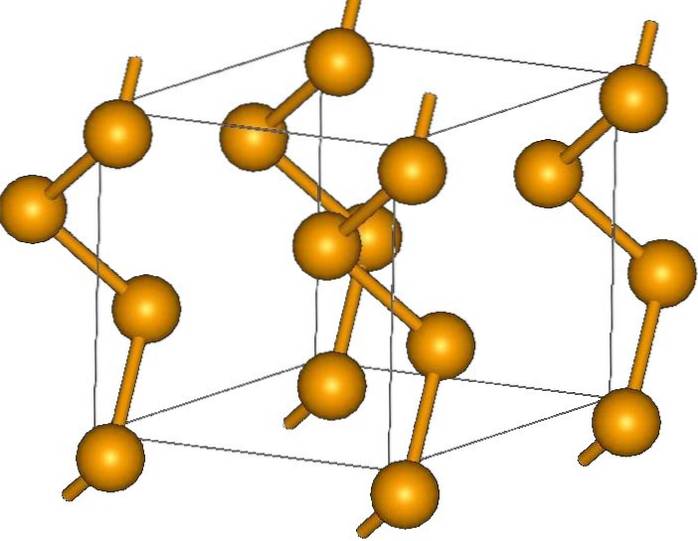
Vid dess ändar kan det finnas terminala dubbelbindningar (-Se = Se) eller Se-ringar8.
- Allotropes
Med tanke på att det kan finnas spiralringar eller kedjor av selen, och att deras dimensioner också kan variera beroende på antalet atomer de innehåller, är det uppenbart att det finns mer än en allotrop för detta element; det vill säga rena selen fasta ämnen men med olika molekylära strukturer.
Rött selen
Bland de mest framstående allotroperna av selen har vi rött, som kan framstå som ett amorft pulver, eller som monokliniska och polymorfa kristaller (se bild av Se8).
I amorft rött selen är strukturerna orörda utan några synliga mönster; medan i linsen skapar ringarna en monoklinisk struktur. Rött kristallint selen är polymorft och har tre faser: α, β och γ, som skiljer sig åt i densiteter..
Svart selen
Strukturen av svart selen består också av ringar; men inte av åtta medlemmar, men av många fler, som når upp till ringar av tusen atomer (Se1000). Det sägs sedan att dess struktur är komplex och består av polymera ringar; några större eller mindre än andra.
Eftersom det finns polymera ringar av olika storlek är det svårt att förvänta sig att de skapar en strukturell ordning; så det svarta selenet är också amorft, men i motsats till det rödaktiga pulvret som nämns ovan har det glasiga strukturer, även om det är sprött.
Grått selen
Och slutligen är av de enklaste allotroperna av selen grå, som sticker ut över de andra eftersom den är den mest stabila under normala förhållanden, och har också ett metalliskt utseende..
Dess kristaller kan vara sexkantiga eller trigonala, etablerade av Londons dispersionskrafter mellan dess polymera spiralformiga kedjor (övre bild). Vinklarna på deras bindningar är 130,1 º, vilket indikerar en positiv avvikelse från den tetraedriska omgivningen (med vinklar på 109,5 º)..
Därför ger selen heliska kedjor intrycket av att vara "öppna". I syfte att belysa, i denna struktur är atomerna vända mot varandra, så i teorin måste det finnas en större överlappning av deras orbitaler för att skapa ledningsband.
Värmen med ökningen av de molekylära vibrationerna skadar dessa band när kedjorna störs; medan energin hos en foton direkt påverkar elektronerna, stimulerar dem och främjar deras transaktioner. Ur denna synvinkel är det "lätt" att föreställa sig fotokonduktiviteten för grått selen..
Var det är placerat och produktion
Även om det är mycket distribuerat är selen ett sällsynt element. Det finns i sitt ursprungliga tillstånd associerat med svavel och mineraler såsom eukairit (CuAgSe), klaustalit (PbSe), naumanit (AgtvåSe) och krokosite [(CuTiAg)tvåJag vet].
Selen finns som en orenhet som ersätter svavel i en liten del av svavelmineralerna i metaller. såsom koppar, bly, silver etc..
Det finns jordar där selen finns i löslig form av selenat. Dessa transporteras av regnvattnet till floderna och därifrån till havet.
Vissa växter kan absorbera och koncentrera selen. Till exempel innehåller en kopp paranötter 544 µg selen, en mängd som motsvarar 777% av den dagliga rekommenderade mängden selen..
Hos levande varelser finns selen i vissa aminosyror, såsom: selenometionin, selenocystein och metylselenocystein. Selenocystein och selenit reduceras till väteselenid.
Elektrolys av koppar
Det finns ingen brytning av selen. Det mesta erhålls som en biprodukt av raffineringsprocessen av kopparelektrolys, som finns i slammet som ackumuleras vid anoden..
Det första steget är produktionen av selen. För detta behandlas det anodiska slammet med natriumkarbonat för att producera dess oxidation. Därefter tillsättes vatten till selenoxid och det surgörs för att bilda selensyra..
Slutligen behandlas selensyra med svaveldioxid för att minska den och erhålla elementärt selen..
I en annan metod i blandningen av slam och slam som bildas vid framställningen av svavelsyra erhålls ett orent rött selen som upplöses i svavelsyra..
Selensyra och selensyra bildas sedan. Denna selensyra får samma behandling som den tidigare metoden.
Klor, som verkar på metallselenider, kan också användas för att producera flyktiga klorerade selenföreningar; såsom: SetvåCltvå, SeCl4, SeCltvå och SeOCltvå.
Dessa föreningar, i en process som utförs i vatten, omvandlas till selenious syra, som behandlas med svaveldioxid för att frigöra selen..
Biologisk roll
Brist
Selen är ett viktigt spårämne för växter och djur, vars brist på människor har orsakat allvarliga störningar som Keshans sjukdom. en sjukdom som kännetecknas av skada på hjärtinfarkt.
Dessutom är selenbrist associerad med manlig infertilitet och kan spela en roll i Kashin-Beck-sjukdomen, en typ av artros. Selenbrist har också observerats vid reumatoid artrit.
Enzymkofaktor
Selen är en komponent av enzymer med antioxidantverkan, såsom glutationperoxidas och tioredoxinreduktas som verkar för att eliminera ämnen med reaktivt syre..
Dessutom är selen en kofaktor av sköldkörtelhormon deiodinaser. Dessa enzymer är viktiga för att reglera sköldkörtelhormonernas funktion..
Användningen av selen har rapporterats vid behandling av Hasimotos sjukdom, en autoimmun sjukdom med bildande av antikroppar mot sköldkörtelceller..
Selen har också använts för att minska de toxiska effekterna av kvicksilver, eftersom vissa av dess åtgärder utövas på selenberoende antioxidantenzymer.
Proteiner och aminosyror
Människan har cirka 25 selenoproteiner som utövar en antioxidantverkan för att skydda mot oxidativ stress, initierad av ett överskott av reaktiva syrearter (ROS) och reaktiva kvävearter (NOS)..
Närvaron av aminosyrorna selenometiocin och selenocystein har detekterats hos människor. Selenometionin används som ett kosttillskott vid behandling av selenbristtillstånd.
Risker
En hög kroppskoncentration av selen kan ha många skadliga effekter på hälsan, med början på sprött hår och spröda naglar, mot hudutslag, värme, hudödem och svår smärta.
Vid behandling av selen i kontakt med ögonen kan människor uppleva sveda, irritation och sönderrivning. Under tiden kan långvarig exponering för rök med hög selen orsaka lungödem, vitlöksandedräkt och bronkit..
Dessutom kan personen uppleva lunginflammation, illamående, frossa, feber, ont i halsen, diarré och hepatomegali..
Selen kan interagera med andra läkemedel och kosttillskott, såsom antacida, antineoplastiska läkemedel, kortikosteroider, niacin och p-piller..
Selen har förknippats med en ökad risk för hudcancer. En studie av National Cancer Institute visade att män med en hög kroppsnivå av selen var dubbelt så benägna att drabbas av aggressiv prostatacancer.
En studie indikerar att det dagliga intaget av 200 µg selen ökar möjligheten att utveckla typ II-diabetes med 50%.
Applikationer
Kosmetika
Selen sulfid används vid behandling av seborré, samt fett- eller mjällhår.
Läkare
Det används som ett alternativ läkemedel vid behandling av Hasimotos sjukdom, en autoimmun sjukdom i sköldkörteln.
Selen minskar kvicksilvers toxicitet, en av dess toxiska aktiviteter utövas på deoxiderande enzymer, som använder selen som en kofaktor.
Manganelektrolys
Användningen av selenoxid vid elektrolys av mangan minskar avsevärt kostnaderna för tekniken, eftersom det minskar elförbrukningen.
Pigment
Selen används som pigment i färger, plast, keramik och glas. Beroende på det selen som används varierar glasets färg från djupröd till ljusorange..
Fotoledande
På grund av egenskapen hos grått selen för att ändra dess elektriska ledningsförmåga som en funktion av ljusets intensitet som utstrålar det, har selen använts i kopiatorer, fotoceller, fotometrar och solceller.
Användningen av selen i kopieringsmaskiner var en av de viktigaste tillämpningarna av selen; men utseendet på organiska fotoledare har minskat deras användning.
Kristaller
Selen används för missfärgning av glas, som ett resultat av närvaron av järn som ger en grön eller gul färg. Dessutom tillåter det en röd färg på glaset, beroende på vilken användning du vill ge det..
Vulkanisering
Diethylditiokarbonatselen används som ett vulkaniseringsmedel i gummiprodukter.
Legeringar
Selen används i kombination med vismut i mässing för att ersätta bly; Mycket giftigt element som har minskat användningen på grund av rekommendationer från hälsoorganisationer.
Selen tillsätts i låga koncentrationer till stål och kopparlegeringar för att förbättra användningen av dessa metaller..
Likriktare
Selenlikriktare började användas 1933 fram till 1970-talet, då de ersattes av kisel på grund av dess låga kostnad och överlägsna kvalitet..
Referenser
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Återställd från: raci.org.au
- Wikipedia. (2019). Selen. Återställd från: en.wikipedia.org
- Sato Kentaro. (s.f.). Nya Allotropes av huvudgruppselement. [PDF]. Återställd från: tcichemicals.com
- Dr. Dough Stewart. (2019). Fakta om selenelement. Chemicool. Återställd från: chemicool.com
- Robert C. Brasted. (28 augusti 2019). Selen. Encyclopædia Britannica. Återställd från: britannica.com
- Marques Miguel. (s.f.). Selen. Återställd från: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (03 juli 2019). Fakta om selen. Återställd från: thoughtco.com
- Lenntech B. V. (2019). Periodiskt system: selen. Återställd från: lenntech.com
- Tinggi U. (2008). Selen: dess roll som antioxidant i människors hälsa. Miljöhälsa och förebyggande medicin, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Kontoret för kosttillskott. (9 juli 2019). Selen: Faktablad för vårdpersonal. National Institute of Health. Återställd från: ods.od.nih.gov



Ingen har kommenterat den här artikeln än.