
Ammoniumsulfat Kemisk struktur, egenskaper och användningar

De ammoniumsulfat Det är ett ternärt oorganiskt salt av svavelsyra. Dess kemiska formel är (NH4)tvåSW4. Därför säger de stökiometriska proportionerna att det för varje sulfatanjon finns två ammoniumkatjoner som interagerar med den. Detta tillåter saltets neutralitet ((+1) ∙ 2 + (-2)).
Dess nomenklatur beror på att det är ett salt som härrör från HtvåSW4, ändra suffixet "uric" med "ato". Således ersätts de två initiala protonerna med NH4+, produkt av reaktion med ammoniak (NH3). Så den kemiska ekvationen för dess syntes är: 2 NH3 + HtvåSW4 => (NH4)tvåSW4
Ammoniumsulfat är en kväve- och svavelbuffert, både väsentlig i jordkemi och gödselmedel..
Artikelindex
- 1 Kemisk struktur
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Molekylvikt
- 2.2 Fysiskt utseende
- 2.3 Lukt
- 2.4 Smältpunkt
- 2.5 Löslighet
- 2.6 Densitet
- 2.7 Ångtryck
- 2.8 Flampunkt
- 2,9 pH
- 2.10 Stabilitet
- 2.11 Sönderfall
- 2.12 Korrosion
- 3 användningsområden
- 3.1 Inom jordbruket
- 3.2 Som ett analytiskt reagens
- 3.3 I utfällning och isolering av proteiner
- 3.4 Inom industrin
- 3.5 Andra användningsområden
- 4 Referenser
Kemisk struktur
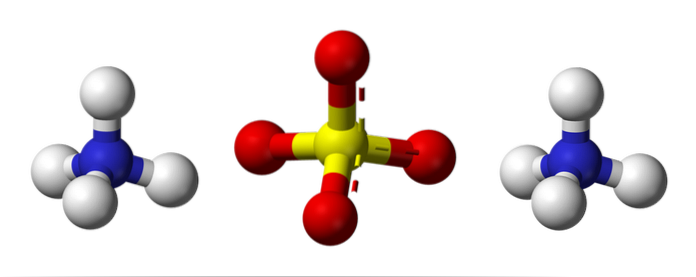
Den översta bilden illustrerar NH-jons molekylära geometrier4+ Och så4två-. De röda sfärerna motsvarar syreatomerna, de vita kulorna till väteatomerna, de blå till kväveatomen och den gula till svavelatomen.
Båda jonerna kan betraktas som två tetraeder, och har således tre enheter som samverkar för att bilda ett ortorombiskt kristallarrangemang. Sulfatanjonen är SO4två- och kan donera eller acceptera fyra vätebindningar, precis som NH-katjonen4+.
Fysiska och kemiska egenskaper
Molekylvikt
132,134 g / mol.
Fysiskt utseende
Fast vit. Vita eller bruna ortorombiska kristaller, beroende på föroreningsnivåer.
Odör
Toalett.
Smältpunkt
280 ° C Denna smältpunkt, låg jämfört med andra jonföreningar, beror på det faktum att det är ett salt med monovalenta katjoner (+1) och med olika joner i sina storlekar, vilket gör att det fasta ämnet har en låg kristallin gitterenergi..
Löslighet
76,4 g / 100 g vatten vid 25 ° C Denna affinitet för vatten beror på dess stora förmåga att solvera ammoniumjoner. Å andra sidan är det olösligt i aceton och alkohol; i lösningsmedel som är mindre polära än vatten.
Densitet
1,77 g / cm3 vid 25 ºC.
Ångtryck
1871 kPa vid 20 ºC.
Flampunkt
26 ºC.
pH
5,0-6,0 (25 ° C. 1 M lösning). Det svagt sura pH-värdet beror på hydrolysen av NH4+ i vatten och producerar H3ELLER+ vid låga koncentrationer.
Stabilitet
Stabil under lämpliga miljöförhållanden. Vid kontakt med starka oxidationsmedel kan det antändas.
Sönderfall
Det börjar sönderdelas vid 150 ° C och frigör giftiga ångor av svaveloxid, kväveoxid och ammonium.
Korrosion
Angriper inte järn eller aluminium.
Applikationer

I jordbruket
- Ammoniumsulfat används som gödningsmedel i alkaliska jordar. Ammoniumsaltet har i sin sammansättning 21% kväve och 24% svavel. Det finns emellertid föreningar som ger en större mängd kväve än ammoniumsulfat; fördelen med den senare är dess höga koncentration av svavel.
- Svavel är viktigt vid proteinsyntes, eftersom flera aminosyror - som cystin, metionin och cystein - har svavel. Av dessa skäl fortsätter ammoniumsulfat att vara ett av de viktigaste gödningsmedlen.
- Det används i grödor av vete, majs, ris, bomull, potatis, hampa och fruktträd.
- Det sänker pH för alkaliska jordar på grund av dess bidrag till nitrifikationsprocessen som utförs av mikrober. Ammonium (NH4+) för att producera nitrat (NO3-) och släpp H+: 2NH4+ + 4: etvå => 2NO3- + 2HtvåO + 4H+. Att öka vätgaskoncentrationen sänker pH för alkaliska jordar och möjliggör mer användning.
- Förutom dess användning som gödningsmedel fungerar ammoniumsulfat som ett komplement till lösliga insekticider, herbicider och fungicider som sprutas på grödor..
- Sulfat kan binda joner som finns i jorden och i bevattningsvatten som är nödvändiga för livet hos vissa patogener. Bland jonerna som ammoniumsulfat fångar upp sig är Catvå+, Mgtvå+, trotvå+ och tron3+. Denna åtgärd förstärker den mikrobicidala effekten av de nämnda medlen..
Som ett analytiskt reagens
Ammoniumsulfat fungerar som ett utfällningsmedel vid elektrokemisk analys, i mikrobiologiskt odlingsmedium och vid framställning av ammoniumsalter..
Vid utfällning och isolering av proteiner
Ammoniumsulfat används vid isolering och rening av proteiner, särskilt plasmaproteiner. En mängd ammoniumsulfat tillsätts till plasman för att bringa den till en viss koncentration; sålunda orsakas utfällningen av en grupp proteiner.
Fällningen uppsamlas genom centrifugering och ytterligare en mängd ammoniumsulfat tillsätts till supernatanten och vid en ny koncentration sker utfällningen av en annan grupp proteiner..
Upprepningen av den tidigare processen på ett sekventiellt sätt möjliggör som ett resultat erhållande av olika fraktioner av plasmaproteiner.
Innan den nya teknologin för molekylärbiologi uppträdde tillät detta förfarande isolering av plasmaproteiner av stor betydelse inom medicin, till exempel: immunglobuliner, koagulationsfaktorer etc..
Inom industrin
Ammoniumsulfat verkar genom att fördröja brandstart i textilindustrin. Det används som tillsats i galvaniseringsindustrin. Det används också vid produktion av väteperoxid, ammoniumklorid etc..
Andra användningsområden
- Ammoniumsulfat används som ett osmotiskt tryckreglerande medel och som ett saltutfällningsmedel..
- I form av ammoniumlaurylsulfat reducerar det vattens ytspänning, vilket möjliggör separering av föroreningar genom att öka hårdheten i vattnet..
- Det är ett antikorrosivt medel.
- Det används som livsmedelstillsats som reglerar surheten i mjöldeg och bröd.
Referenser
- OECD SIDS. (Oktober 2004). Ammoniumsulfat. [PDF]. Hämtad den 27 april 2018 från: inchem.org
- Mosaikföretaget. (2018). Ammoniumsulfat. Hämtad den 27 april 2018 från: cropnutrition.com
- Wikipedia. (2018). Ammoniumsulfat. Hämtad den 27 april 2018 från: en.wikipedia.org
- Pubchem. (2018). Ammoniumsulfat. Hämtad den 27 april 2018 från: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23 juli 2015). [Figur]. Hämtad den 27 april 2018 från: flickr.com
- Paula Papp. (22 februari 2017). Ammoniumsulfatapplikationer och användningsområden. Hämtad den 27 april 2018 från: business.com

Ingen har kommenterat den här artikeln än.