
Kaliumtiocyanat (KSCN) struktur, egenskaper, användningsområden

De kaliumtiocyanat Det är en oorganisk förening bildad av elementen kalium (K), svavel (S), kol (C) och kväve (N). Dess kemiska formel är KSCN. Det är ett färglöst eller vitt fast ämne som är mycket lösligt i vatten. Den består av en kalium K-jon+ och en SCN-tiocyanatjon-. KSCN finns rikligt i saliv.
Kaliumtiocyanat används som laboratoriereagens för olika typer av kemisk analys. Det används också i bläck och färger.

KSCN har använts för att lösa upp dentingelatin (material under tandemaljen) före applicering av tandreparationsmaterial eller harts. Det används också i forskning om vacciner, eftersom det möjliggör extraktion av vissa biokemiska element från bakterier.
Den används i form av en lösning där metaller löses upp under poleringsprocessen genom elektricitet eller elektropolering. Det har också använts för att få falskt blod för filmer och pjäser.
Ibland missbrukas det för att öka mjölkens stabilitet när den inte förvaras i kyl. Men det har nackdelen att det orsakar hypotyreos, en sjukdom där sköldkörteln inte fungerar..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Sönderfallstemperatur
- 3.5 Densitet
- 3.6 Löslighet
- 3,7 pH
- 3.8 Övriga egenskaper
- 4 Skaffa
- 4.1 Närvaro i naturen
- 5 användningsområden
- 5.1 I olika applikationer
- 5.2 I tandläkartillämpningar
- 5.3 I medicinska laboratorier
- 5.4 Inom metallindustrin
- 5.5 På uppsättningen filmer eller i teatern
- 5.6 Missbruk av kaliumtiocyanat
- 6 risker
- 7 Referenser
Strukturera
Kaliumtiocyanat består av en kalium-K-katjon+ och en NCS-tiocyanatanjon-. Det senare bildas av ett kväve (N) fäst till ett kol (C) genom en trippelbindning och ett svavel (S) fäst till kol genom en enda bindning.
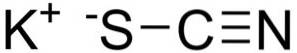
Nomenklatur
- Kaliumtiocyanat
- Kaliumsulfocyanat
- Kaliumsalt av tiocyansyra
- Kalium Rodanat
- Kalium rodanid
Egenskaper
Fysiskt tillstånd
Färglös eller vit fast substans.
Molekylvikt
97,18 g / mol
Smältpunkt
173 ºC
Sönderfallstemperatur
500 ºC
Densitet
1,88 g / cm3
Löslighet
Mycket löslig i vatten: 217 g / 100 ml vid 20 ° C, 238 g / 100 ml vid 25 ° C. Löslig i etanol.
pH
En 5% lösning av KSCN har ett pH mellan 5,3 och 8,7.
Andra egenskaper
Rena, torra kaliumtiocyanatprover är stabila på obestämd tid när de förvaras i mörkret i tätt täckta glasburkar. I kontakt med direkt solljus blir de färglösa kristallerna dock snabbt gulaktiga..
Lösningar av rent KSCN-salt skyddat från ljus är helt stabila.
KSCN kan svälla gelatin och kollagen. Vattenlösningar av kaliumtiocyanat vid reaktion med mangandioxid MnOtvå oxidera och bilda tiocyanogen (SCN)två.
Erhållande
Kaliumtiocyanat kan framställas genom att smälta kaliumcyanid (KCN) med svavel (S). Reaktionen är snabb och kvantitativ.
KCN + S → KSCN
Den kan erhållas i lösning genom att lösa upp svavel (S) i bensen eller aceton och tillsätta en lösning av kaliumcyanid (KCN) i isopropanol. Denna reaktion används för att analysera mängden svavel i en lösning.
Kaliumtiocyanat kan erhållas rent genom successiva omkristallisationer från vatten eller etanol..
Närvaro i naturen
Kaliumtiocyanat finns i saliv rikligt (15 mg / dL), men det saknas i blodet.
Även mjölken hos vissa däggdjur (såsom kor) har mycket små mängder tiocyanat naturligt.
Applikationer
I olika applikationer
Kaliumtiocyanat har använts i olika kemiska analyser. Det har använts för analys eller titrering av silverjon, också som ett reagens och indikator för andra analyser.
KSCN används i färgämnen och pigment. Används i färger och färger.
Inom fotografiindustrin används den speciellt vid tillverkning av fotografifilmer, eftersom den tjänar till att möjliggöra en fast avsättning av gelatin från plastfilmer..
Koncentrationen av tiocyanat i blod har använts i medicovetenskapliga experiment för att bestämma i vilken grad vissa människor röker, eftersom tiocyanat är en produkt härrörande från vätecyanid (HCN) som finns i tobaksrök..
I tandläkartillämpningar
Kaliumtiocyanat har använts vid reparation av djurtänder. Det har framgångsrikt applicerats på dentinytan som en förbehandling innan det appliceras medlet för att fylla eller plugga det öppna hålet.
Dentin är skiktet som finns under emaljen på tänderna.
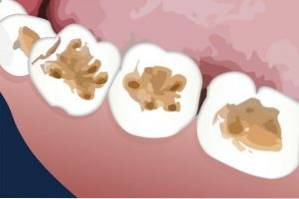
Kaliumtiocyanat gynnar svullnaden av gelatinet som finns på dentinet, så detta skikt avlägsnas lätt och en bättre vidhäftning eller bindning av materialet som tätar tanden (hartset) blir resultatet..
I medicinska vetenskapslaboratorier
KSCN används vid beredning av vacciner eller bakteriextrakt.
De patogena bakterierna odlas genom inkubation i lämpliga laboratoriebehållare. Sedan tillsätts en fosfat pH-regulator och KSCN till behållaren där bakteriekulturen är belägen..
En del av denna bakterieberedning tas och placeras i en burk. Den omröres under en lämplig tid och suspensionen centrifugeras för att separera vätskan från det fasta materialet. Supernatanten (flytande) uppsamlas och dialyseras.
Resultatet är ett extrakt som används för att vaccinera i vetenskapliga experiment med försöksdjur..
Inom metallindustrin
Kaliumtiocyanat används vid elektropolering av metaller. Elektropolering är en kemisk process som gör det möjligt att behandla ytan på en metall för att minska dess mikro-grovhet, det vill säga för att släta metallytan.
Detta görs med elektricitet, vilket gör att metallen slätas för att fungera som den positiva polen eller anoden i elektrolytcellen. Ojämnheten löses upp i kaliumtiocyanatlösningen och metallen blir därmed mjukare.
På uppsättningen filmer eller i teatern
KSCN används vid simulering av blod i film- och tv-filmer eller i pjäser.
Till exempel appliceras en lösning av kaliumtiocyanat (KSCN) på kroppens område som kommer att "drabbas" av snittet eller simulerat angrepp. Plastkniven eller det simulerade skärföremålet badas i en lösning av järnklorid (FeCl3).
Det "skarpa" föremålet som har FeCl passeras försiktigt3 på hud fuktad i KSCN. Omedelbart kommer en röd strimma eller fläck att bilda mycket liknande blodets.
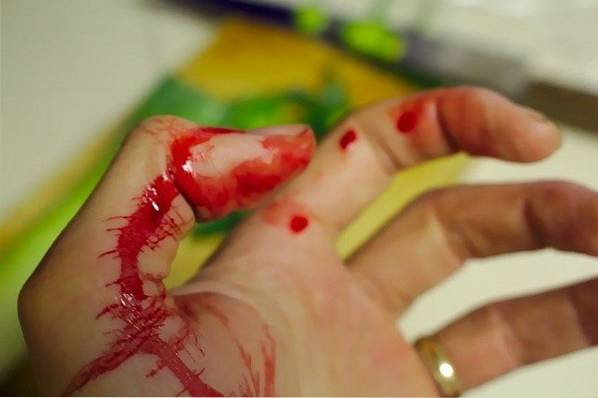
Detta beror på bildandet av ett komplex av järntiocyanat och vatten [Fe (NCS) (HtvåELLER)5]två+ som har en intensiv röd färg som mycket liknar blod:
KSCN + FeCl3 + 5 timmartvåO → [Fe (NCS) (HtvåELLER)5]två+ + 2 Cl- + KCl

Kaliumtiocyanatmissbruk
Kaliumtiocyanat används samvetslöst för att förhindra att mjölk attackeras av bakterier eller svampar, förlorar dess egenskaper och försämras.
I tropiska länder används en metod som kallas "lakto-peroxidas-system" eller LP-system, vilket ökar mjölkens stabilitet vid förvaring vid höga omgivningstemperaturer, när kylning inte är möjlig..

Denna metod använder det naturliga antibakteriella systemet med mjölk, som aktiveras genom att öka koncentrationen av tiocyanat (redan närvarande i små mängder i mjölk) och väteperoxid (HtvåELLERtvå).
Denna metod är dock inte tillåten i många länder av myndigheter som reglerar bearbetade livsmedel..
Vissa skrupelfria människor lägger till KSCN för att mjölka irrationellt med eller utan HtvåELLERtvå, vilket utgör en fara för konsumentens hälsa, eftersom tiocyanater är ämnen som orsakar skador på sköldkörteln och kan orsaka hypotyreos vid intag i höga koncentrationer.

Risker
Inandning av kaliumtiocyanatpulver bör undvikas. Det är tillrådligt att använda handskar och skyddsglasögon när du hanterar det. Efter kort exponering för kaliumtiocyanat kan det orsaka effekter på nervsystemet, såsom överdriven känsla utan motiv, agitation och anfall..
Efter en lång exponering kan sköldkörteln och centrala nervsystemet påverkas, vilket manifesteras som hypotyroidism respektive försämring av vissa funktioner. Vid intag kan det orsaka förvirring, illamående, kräkningar, kramper och svaghet..
Tändning eller förbränning av KSCN släpper ut mycket giftiga cyanidgaser; detta händer också när man tillsätter syror. I laboratoriet ska den hanteras i en väl ventilerad dragskåp..
Referenser
- Jarvinen, L.Z. et al. (1998). Induktion av skyddande immunitet hos kaniner genom samadministrering av inaktiverade Pasteurella multocida Toxin- och kaliumtiocyanatextrakt. Infektion och immunitet, aug 1998, s. 3788-3795. Återställd från ncbi.nlm.nih.gov.
- Tani, Y. och Togaya, T. (1995). Dentins ytbehandling utan syror. Dental Materials Journal 14 (1): 58-69, 1995. Hämtad från jstage.jst.go.jp.
- Kolthoff, I.M. och Lingane, J.J. (1935). Kaliumtiocyanat som primärt standardämne. Journal of the American Chemical Society 1935, 57, 11, 2126-2131. Återställd från pubs.acs.org.
- Balmasov, A.V. et al. (2005). Elektropolering av silver i vatten-organiska lösningar av kaliumtiocyanat. Prot Met 41, 354-357 (2005). Återställd från link.springer.com.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Lide, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Tyner, T. och Francis, J. (2017). Kaliumtiocyanat. ACS-reagenskemikalier. Återställd från pubs.acs.org.
- Kanthale, P. et al. (2015). Kvalitativt test för detektion av främmande tiocyanat i mjölk. J Food Sci Technol (mars 2015) 52 (3): 1698-1704. Återställd från ncbi.nlm.nih.gov.
- Roy, D. et al. (2018) Silicon Quantum Dot-Based Fluorescent Probe: Synthesis Characterization and Recognition of Thiocyanate in Human Blood. ACS Omega 2018, 3, 7, 7613-7620. Återställd från pubs.acs.org.
- Gammon, K. (2018). Vetenskapen om falskt blod. Inside Science. Återställd från insidescience.org.


Ingen har kommenterat den här artikeln än.