
Titinastruktur, funktioner och relaterade patologier
Titina är termen som används för att beskriva ett par jätte polypeptidkedjor som utgör det tredje vanligaste proteinet i sarkomererna i ett brett spektrum av skelett- och hjärtmuskler.
Titin är ett av de största kända proteinerna när det gäller antalet aminosyrarester och därför i termer av molekylvikt. Detta protein är också känt som anslutning och finns i både ryggradsdjur och ryggradslösa djur.
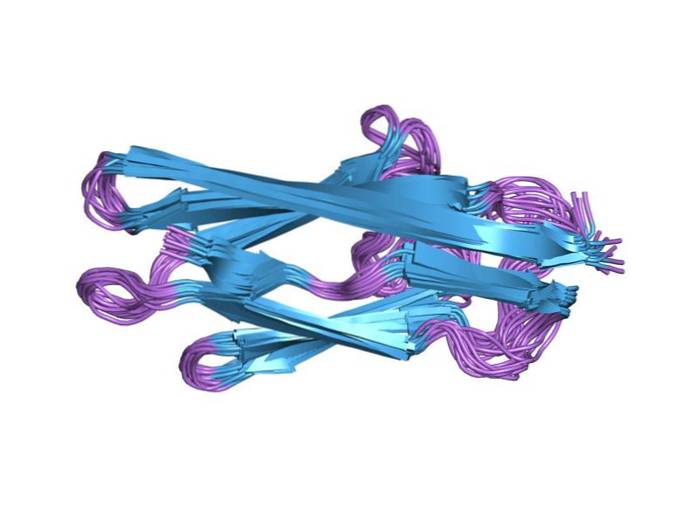
Det beskrevs med detta namn (connectin) för första gången 1977 och 1979 definierades det som dubbelbandet i den övre delen av en polyakrylamidgelelektroforesgel under denatureringsförhållanden (med natriumdodecylsulfat). 1989 fastställdes dess plats genom immunoelektronmikroskopi.
Tillsammans med ett annat stort protein, nebulin, är titin en av huvudkomponenterna i det elastiska nätverket i muskelcellens cytoskelet som samexisterar med de tjocka trådarna (myosin) och de tunna filamenten (aktin) i sarkomererna så mycket att det är känt som det tredje filamentsystemet av muskelfibrer.
De tjocka och tunna filamenten är ansvariga för alstringen av den aktiva kraften, medan titinfilamenten bestämmer viskoelasticiteten hos sarkomererna.
En sarkomer är den upprepande enheten av myofibriller (muskelfibrer). Den är ungefär 2 μm lång och avgränsas av "plattor" eller linjer som kallas Z-linjer, som segmenterar varje myofibril i remsade fragment med definierad storlek.
Titinmolekyler samlas i extremt långa, flexibla, tunna och töjbara trådsträngar. Titin är ansvarig för elasticiteten i skelettmuskeln och tros fungera som en molekylär byggnadsställning som specificerar korrekt sammansättning av sarkomerer i myofibriller..
Artikelindex
- 1 Struktur
- 2 funktioner
- 2.1 Övriga funktioner
- 3 Relaterade patologier
- 4 Referenser
Strukturera
Hos ryggradsdjur har titin cirka 27 000 aminosyrarester och en molekylvikt på cirka 3 MDa (3 000 kDa). Den består av två polypeptidkedjor kända som T1 och T2, som har liknande kemiska kompositioner och liknande antigena egenskaper..
I musklerna hos ryggradslösa djur är "mini-titiner”Med mellan 0,7 och 1,2MDa molekylvikt. Denna grupp av proteiner inkluderar proteinet "Twitchina" från Caenorhabditis elegans och protein "Projectin" finns i genre Drosophila.
Vertebrat titin är ett modulärt protein som huvudsakligen består av immunglobulin och fibronektin III-liknande domäner (FNIII-tycka om) ordnade i sats. Den har en elastisk region rik på prolin-, glutaminsyra-, valin- och lysinrester känd som PEVK-domänen och en annan serinkinasdomän vid dess karboxylterminala ände..
Var och en av domänerna är ungefär 100 aminosyror lång och är känd som klass I-titin (den fibronektinliknande domänen III) och klass II-titin (den immunglobulinliknande domänen). Båda domänerna viks in i 4 nm långa "sandwich" -strukturer som består av antiparallella β-ark..
Hjärtanslutningsmolekylen innehåller 132 upprepade motiv av immunglobulindomänen och 112 upprepade motiv av den fibronektin III-liknande domänen..
Den kodande genen för dessa proteiner (TTN) är "mästare" för introner eftersom den har nästan 180 av dessa inuti.
Transkriptionerna av underenheterna behandlas differentiellt, särskilt de kodande regionerna för immunglobulin (Ig) och PEVK-liknande domäner, vilket ger upphov till isoformer med olika töjbara egenskaper..
Funktioner
Titins funktion i sarkomerer beror på dess associering med olika strukturer: dess C-terminala ände är förankrad till M-linjen, medan den N-terminala änden av varje titin är förankrad till Z-linjen.
Nebulin- och titinproteinerna fungerar som "molekylära linjaler" som reglerar längden på de tjocka respektive tunna filamenten. Titin sträcker sig, som nämnts, från Z-skivan till bortom M-linjen, i mitten av sarkomeren, och reglerar dess längd, vilket förhindrar översträckning av muskelfibrerna..
Det har visat sig att vikning och vikning av titin hjälper muskelsammandragningsprocessen, det vill säga det genererar det mekaniska arbetet som uppnår förkortning eller förlängning av sarkomererna; medan tjocka och tunna fibrer är de rörliga molekylmotorerna.
Titin deltar i underhållet av de tjocka filamenten i mitten av sarkomeren och dess fibrer är ansvariga för genereringen av passiv spänning under sträckningen av sarkomererna..
Andra funktioner
Förutom sitt deltagande i genereringen av den viskoelastiska kraften har titin andra funktioner, bland annat:
-Deltagande i mekanokemiska signalhändelser genom dess associering med andra sarkomera och icke-sarkomera proteiner
-Längdberoende aktivering av kontraktilapparaten
-Sarcomere montering
-Bidrag till bland annat cytoskelettets struktur och funktion hos ryggradsdjur.
Vissa studier har visat att i humana celler och embryon från Drosophila, titin har en annan funktion som ett kromosomalt protein. Det renade proteinets elastiska egenskaper motsvarar perfekt de elastiska egenskaperna hos kromosomerna hos både levande celler och sammansatta kromosomer. in vitro.
Deltagandet av detta protein i komprimering av kromosomer har visats tack vare platsinriktade mutagenesexperiment av genen som kodar det, vilket resulterar i både muskel- och kromosomfel..
Lange et al. 2005 visade att titinkinasdomänen har att göra med det komplexa uttryckssystemet för muskelgener, ett faktum som demonstreras av mutationen av denna domän som orsakar ärftliga muskelsjukdomar.
Relaterade patologier
Vissa hjärtsjukdomar är förknippade med förändringar i titins elasticitet. Sådana förändringar påverkar kraftigt töjbarheten och den passiva diastoliska stelheten hos myokardiet och förmodligen mekanosensitiviteten..
Gen TTN har identifierats som en av de viktigaste generna som är involverade i humana sjukdomar, så hjärtproteins egenskaper och funktioner har studerats omfattande de senaste åren.
Dilaterad kardiomyopati och hypertrofisk kardiomyopati är också produkten av mutationen av flera gener, inklusive genen TTN.
Referenser
- Despopoulos, A., & Silbernagl, S. (2003). Färgatlas för fysiologi (5: e upplagan). New York: Thieme.
- Herman, D., Lam, L., Taylor, M., Wang, L., Teekakirikul, P., Christodoulou, D.,… Seidman, C. E. (2012). Trunkeringar av titin som orsakar dilaterad kardiomyopati. New England Journal of Medicine, 366(7), 619-628.
- Keller, T. (1995). Struktur och funktion av titin och nebulin. Aktuellt yttrande inom biologi, 7, 32-38.
- Lange, S., Lange, S., Xiang, F., Yakovenko, A., Vihola, A., Hackman, P., ... Gautel, M. (2005). Kinas-domänen för titin kontrollerar muskelgenuttryck och proteinomsättning. Vetenskap, 1599-1603.
- Linke, W. A., & Hamdani, N. (2014). Gigantiska affärer: Titins egenskaper och funktion genom tjock och tunn. Cirkulationsforskning, 114, 1052-1068.
- Machado, C., & Andrew, D. J. (2000). D-TITIN: ett jätteprotein med dubbla roller i kromosomer och muskler. Journal of Cell Biology, 151(3), 639-651.
- Maruyama, K. (1997). Jätte elastiskt protein av muskler. FASEB Journal, elva, 341-345.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principer för biokemi. Omega-utgåvor (5: e upplagan).
- Rivas-Pardo, J., Eckels, E., Popa, I., Kosuri, P., Linke, W., & Fernández, J. (2016). Arbetet gjort av Titin Protein Folding Assists Muscle Contraction. Cellrapporter, 14, 1339-1347.
- Trinick, J. (1994). Titin och nebulin: proteinlinjaler i muskler? Trender inom biokemiska vetenskaper, 19, 405-410.
- Tskhovrebova, L. och Trinick, J. (2003). Titin: Egenskaper och familjerelationer. Naturrecensioner, 4, 679-6889.
- Wang, K., Ramirez-Mitchell, R., & Palter, D. (1984). Titin är ett extremt långt, flexibelt och smalt myofibrillärt protein. Proc. Natl. Acad. Sci., 81, 3685-3689.


Ingen har kommenterat den här artikeln än.