
Volframhistoria, egenskaper, struktur, användningsområden
De volfram, volfram eller volfram är en tung övergångsmetall vars kemiska symbol är W. Den ligger i period 6 med grupp 6 i det periodiska systemet och dess atomnummer är 74. Namnet har två etymologiska betydelser: hård sten och vargskum; av det andra beror på att denna metall också är känd som volfram.
Det är en silvergrå metall och även om den är spröd, har den stor hårdhet, densitet och höga smält- och kokpunkter. Därför har den använts i alla de applikationer som involverar höga temperaturer, tryck eller mekaniska krafter, såsom borrar, projektiler eller strålningsemitterande filament..

Den mest kända användningen för denna metall, på kulturell och populär nivå, är i glödtrådarnas glödlampor. Den som har manipulerat dem kommer att inse hur ömtåliga de är; emellertid är de inte gjorda av rent volfram, som är smidbart och duktilt. Dessutom ger det i metallmatriser som legeringar utmärkt motstånd och hårdhet.
Det kännetecknas och kännetecknas av att vara metallen med den högsta smältpunkten, och också genom att vara tätare än bly i sig, endast överträffad av andra metaller som osmium och iridium. Det är också den tyngsta metallen som är känd för att spela en biologisk roll i kroppen..
Volframstatianjonen, WO4två-, som kan polymerisera för att bilda kluster i ett surt medium. Å andra sidan kan volfram bilda intermetalliska föreningar eller sintras med metaller eller oorganiska salter så att dess fasta ämnen får olika former eller konsistenser..
Det är inte mycket rikligt i jordskorpan, med bara 1,5 gram av denna metall per ton. Eftersom det dessutom är ett tungt element är dess ursprung intergalaktiskt; specifikt från supernovaexplosioner, som måste ha kastat ”strålar” av volframatomer mot vår planet under dess bildande.
Artikelindex
- 1 Historia
- 1.1 Etymologi
- 1.2 Erkännande och upptäckt
- 1.3 Stål och glödlampor
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Atomnummer
- 2.3 Molmassa
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Fusionsvärme
- 2.8 Förångningsvärme
- 2.9 Molär värmekapacitet
- 2.10 Mohs hårdhet
- 2.11 Elektronegativitet
- 2.12 Atomradie
- 2.13 Elektrisk resistivitet
- 2.14 Isotoper
- 2.15 Kemi
- 2.16 Syrakluster
- 3 Struktur och elektronisk konfiguration
- 3.1 Kristallina faser
- 3.2 Metallbindning
- 3.3 oxidationstillstånd
- 4 Skaffa
- 5 användningsområden
- 6 Risker och försiktighetsåtgärder
- 6.1 Biologiska ämnen
- 6.2 Fysisk
- 7 Referenser
Berättelse
Etymologi
Volfram eller wolfram historia har två ansikten som deras namn: en schweizisk och en annan tysk. På 1600-talet, i regioner som för närvarande ockuperas av Tyskland och Österrike, arbetade gruvarbetare i utvinning av koppar och tenn för att producera brons.
Då fann gruvarbetarna sig en tagg i processen: det fanns ett extremt svårt mineral att smälta; mineral bestående av wolframit, (Fe, Mn, Mg) WO4, som behöll eller "slukade" burken som om det var en varg.
Därav etymologin för detta element, "varg" för varg på spanska, en varg som åt tenn; och "ram" av skum eller grädde, vars kristaller liknade en lång svart päls. Det var alltså som namnet "wolfram" eller "wolfram" uppstod för att hedra dessa första observationer.
År 1758, på den schweiziska sidan, ett liknande mineral, scheelite, CaWO4, den hette 'tung sten', vilket betyder 'hård sten'.
Båda namnen, volfram och volfram, används ofta omväxlande, beroende enbart på kultur. I Spanien till exempel och i västra Europa är denna metall mest känd som volfram; medan på den amerikanska kontinenten dominerar namnet volfram.
Erkännande och upptäckt
Det var då känt att det mellan 1600- och 1700-talet fanns två mineraler: wolframit och scheelite. Men vem såg att det fanns en metall som skilde sig från de andra i dem? De kunde bara karakteriseras som mineraler, och det var 1779 som den irländska kemisten Peter Woulfe noggrant analyserade volfram och drog av förekomsten av volfram..
På schweiziska sidan kunde Carl Wilhelm Scheele 1781 återigen isolera volfram som WO3; och ännu mer fick han volframsyra (eller volframsyra), HtvåWO4 och andra föreningar.
Detta var dock inte tillräckligt för att nå den rena metallen, eftersom det var nödvändigt att minska denna syra; det vill säga att den utsätts för en sådan process att den kopplas från syre och kristalliseras som metall. Carl Wilhelm Scheele hade inte lämpliga ugnar eller metoder för denna kemiska reduktionsreaktion.
Det var här de spanska bröderna d'Elhuyar, Fausto och Juan José, kom till handling, som reducerade båda mineralerna (wolframit och scheelit) med kol, i staden Bergara. Båda tilldelas förtjänsten och äran att vara upptäckarna av metallisk wolfram eller volfram (W).
Stål och glödlampor

Liksom andra metaller definierar dess användningsområde dess historia. Bland de mest framträdande i slutet av 1800-talet var stål-volframlegeringar och volframfilament för att ersätta kol i elektriska glödlampor. Man kan säga att de första glödlamporna, som vi känner dem, marknadsfördes 1903-1904.
Egenskaper
Fysiskt utseende
Det är en glänsande silvergrå metall. Bräckligt men väldigt hårt (inte förväxlas med seghet). Om stycket har hög renhet blir det smidigt och hårt, så mycket eller mer som flera stål.
Atomnummer
74.
Molmassa
183,85 g / mol.
Smältpunkt
3422ºC.
Kokpunkt
5930ºC.
Densitet
19,3 g / ml.
Fusionsvärme
52,31 kJ / mol.
Förångningsvärme
774 kJ / mol.
Molär värmekapacitet
24,27 kJ / mol.
Mohs hårdhet
7.5.
Elektronnegativitet
2,36 på Pauling-skalan.
Atomradio
139.00
Elektrisk resistans
52,8 nΩ · m vid 20 ° C.
Isotoper
Det förekommer främst i naturen som fem isotoper: 182W, 183W, 184W, 186W och 180W. Enligt den molära massan av 183 g / mol, som är medelvärdet av atommassorna för dessa isotoper (och de andra trettio radioisotoperna), har varje volfram- eller volframatom cirka hundra tio neutroner (74 + 110 = 184).
Kemi
Det är en metall som är mycket motståndskraftig mot korrosion, eftersom dess tunna lager av WO3 Det skyddar det mot angrepp av syre, syra och alkalier. När de väl har lösts upp och fällts ut med andra reagenser erhålles dess salter, som kallas volframater eller wolframat; i dem har vanligtvis volfram ett oxidationstillstånd på +6 (förutsatt att det finns katjoner W6+).
Syrakluster
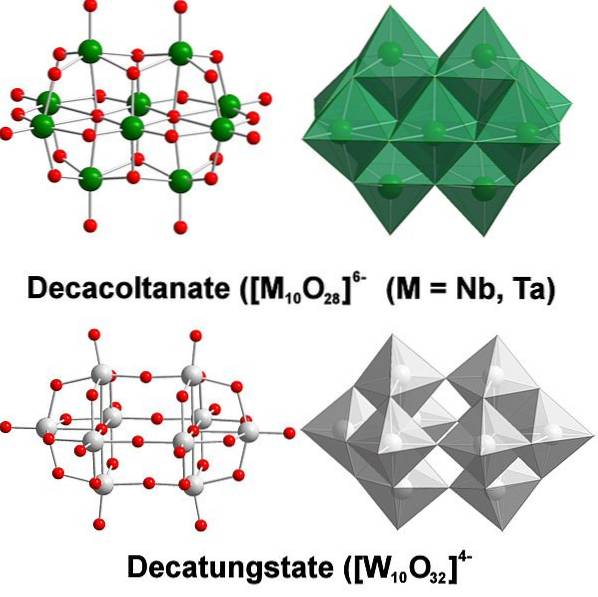
Kemiskt är volfram ganska speciellt eftersom dess joner tenderar att klustras för att bilda heteropolysyror eller polyoxometalater. Vad är dem? De är grupper eller kluster av atomer som samlas för att definiera en tredimensionell kropp; Huvudsakligen en med en sfärisk burliknande struktur, där de "innesluter" en annan atom.
Det hela börjar från volframanjonen, WO4två-, som i surt medium snabbt protonerar (HWO4-) och binder med en angränsande anjon för att bilda [WtvåELLER7(ÅH)två]två-; och detta i sin tur förenas med en annan [WtvåELLER7(ÅH)två]två- för att starta [W4ELLER12(ÅH)4]4-. Så vidare tills det finns flera politiska statistik i lösning.
Paratungstat A och B, [W7ELLER24]6- och HtvåW12ELLER4210-, respektive, de är en av de mest framstående av dessa polyanjoner.
Det kan vara utmanande att komma med dina Lewis-konturer och strukturer; men det räcker i princip att visualisera dem som uppsättningar av WO-oktahedra6 (översta bilden).
Observera att dessa gråaktiga oktaeder slutligen definierar decatungstate, en politungstat; om den innehöll en heteroatom (till exempel fosfor) inuti, skulle det då vara ett polyoxometalat.
Struktur och elektronisk konfiguration
Kristallina faser
Volframatomer definierar en kristall med en kroppscentrerad kubisk struktur (bcc, för kroppscentrerad kubik). Denna kristallina form är känd som a-fasen; medan β-fasen också är kubisk, men lite tätare. Båda faserna eller kristallformerna, α och β, kan samexistera i jämvikt under normala förhållanden.
De kristallina kornen i α-fasen är isometriska, medan de i β-fasen liknar kolumner. Oavsett hur kristallen är, styrs den av metallbindningarna som håller W-atomerna tätt ihop. Annars kunde de höga smält- och kokpunkterna eller den höga hårdheten och densiteten hos volfram inte förklaras..
Metallisk bindning
Volframatomer måste vara tätt bundna på något sätt. För att göra en antagande måste elektronkonfigurationen för denna metall först observeras:
[Xe] 4f145 d46stvå
5d-orbitalerna är mycket stora och otydliga, vilket skulle innebära att det finns effektiva överlappningar mellan två närliggande W-atomer. På samma sätt bidrar 6-orbitalerna till de resulterande banden, men i mindre grad. Medan 4f-orbitalerna är "djupt i bakgrunden" och därför är deras bidrag till metallbindningen mindre.
Detta, storleken på atomerna och de kristallina kornen, är variablerna som bestämmer hårdheten hos volfram och dess densitet..
Oxidationstillstånd
I volfram- eller metallwolfram har W-atomerna noll oxidationstillstånd (W0). När vi återgår till den elektroniska konfigurationen kan 5d- och 6s-orbitalerna "tömmas" för elektroner beroende på om W är i sällskap med starkt elektronegativa atomer, såsom syre eller fluor..
När de två 6-elektronerna går förlorade har volfram oxidationstillstånd +2 (Wtvå+), vilket får dess atom att dra ihop sig.
Om den också förlorar alla elektroner i sina 5d-orbitaler blir dess oxidationstillstånd +6 (W6+); Härifrån kan det inte bli mer positivt (i teorin), eftersom 4f-orbitalerna, eftersom de är inre, skulle kräva stora energier för att ta bort sina elektroner. Det vill säga det mest positiva oxidationstillståndet är +6, där volframet är ännu mindre.
Denna volfram (VI) är mycket stabil under sura förhållanden eller i många syrerade eller halogenerade föreningar. Andra möjliga och positiva oxidationstillstånd är: +1, +2, +3, +4, +5 och +6.
Volfram kan också få elektroner om det kombineras med atomer som är mindre elektronegativa än det. I det här fallet blir dess atomer större. Den kan få maximalt fyra elektroner; det vill säga ha ett oxidationstillstånd av -4 (W.4-).
Erhållande
Det nämndes tidigare att volfram finns i mineralerna wolframit och scheelite. Beroende på processen erhålls två föreningar från dem: volframoxid, WO3, eller ammoniumparatungstat, (NH4)10(HtvåW12ELLER424HtvåO (eller ATP). Endera av dem kan reduceras till metallisk W med kol över 1050 ° C.
Det är inte ekonomiskt lönsamt att producera volframstänger, eftersom de skulle behöva mycket värme (och pengar) för att smälta dem. Det är därför det är föredraget att producera det i pulverform för att behandla det på en gång med andra metaller för att erhålla legeringar..
Det är värt att nämna att Kina är det land som har den största volframproduktionen världen över. Och på den amerikanska kontinenten, Kanada, Bolivia och Brasilien, upptar de också listan över de största tillverkarna av denna metall.
Applikationer

Här är några av de kända användningsområdena för denna metall:
-Dess salter användes för att färglägga bomull av gammal teaterklädsel.
-Kombinerat med stål hårdnar det ännu mer och kan även motstå mekaniska snitt vid höga hastigheter.
-Sintrade volframfilament har använts i över hundra år i elektriska glödlampor och halogenlampor. På grund av dess höga smältpunkt har det också fungerat som ett material för katodstrålerör och för munstyckena för raketmotorer..
-Ersätter bly vid tillverkning av projektiler och radioaktiva sköldar.
-Volframnanotrådar kan användas i pH- och gaskänsliga nanodenheter.
-Volframkatalysatorer användes för att hantera svavelproduktion i oljeindustrin.
-Volframkarbid är den mest använda av alla dess föreningar. Från förstärkning av skär- och borrverktyg eller tillverkning av militärvapen till bearbetning av trä, plast och keramik.
Risker och försiktighetsåtgärder
Biologisk
Eftersom det är en relativt sällsynt metall i jordskorpan är dess negativa effekter knappa. I sura jordar kan polyungstater inte påverka enzymerna som använder molybdatanjoner; men i grundjordar, WO4två- ingriper (positivt eller negativt) i de metaboliska processerna i MoO4två- och koppar.
Växter kan till exempel absorbera lösliga volframföreningar, och när ett djur äter dem och efter att ha konsumerat sitt kött kommer W-atomer in i våra kroppar. De flesta utvisas i urin och avföring, och lite är känt vad som händer med resten av dem..
Djurstudier har visat att när de andas in höga halter av pulver i pulverform utvecklar de symtom som liknar lungcancer.
Vid intag skulle en vuxen människa behöva dricka tusentals liter vatten anrikat med volframsalter för att visa märkbar hämning av enzymerna kolinesteras och fosfatas..
Fysisk
I allmänna termer är volfram ett lågt giftigt element, och därför finns det få miljörisker för hälsoskador..
När det gäller metalliskt volfram, undvik att andas dess damm; och om provet är fast bör man komma ihåg att det är mycket tätt och att det kan orsaka fysisk skada om det faller eller träffar andra ytor.
Referenser
- Bell Terence. (s.f.). Wolfram (Wolfram): Egenskaper, produktion, applikationer och legeringar. Balansen. Återställd från: thebalance.com
- Wikipedia. (2019). Volfram. Återställd från: en.wikipedia.org
- Lenntech B.V. (2019). Volfram. Återställd från: lenntech.com
- Jeff Desjardins. (1 maj 2017). Volframens historia, den starkaste naturliga metallen på jorden. Återställd från: visualcapitalist.com
- Doug Stewart. (2019). Fakta om volframelement. Återställd från: chemicool.com
- Art Fisher och Pam Powell. (s.f.). Volfram. University of Nevada. Återställd från: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (02 mars 2019). Volfram- eller Wolfram-fakta. Återställd från: thoughtco.com


Ingen har kommenterat den här artikeln än.