
Väteperoxid (H2O2) struktur, egenskaper, användningsområden, produktion
De Väteperoxid är en oorganisk förening vars kemiska formel är HtvåELLERtvå. Av allt är det den enklaste peroxiden i denna familj av kemiska föreningar. Dess strukturformel är H-O-O-H, eftersom den är den inre syresatta bryggkarakteristiken för alla peroxider.
1818, HtvåELLERtvå Det identifierades av Louies Jacques Thénard, som framställde en kemisk förening som han kallade väteperoxid vid den tiden. Det är en instabil förening, den bryts ned vid exponering för ljus, värme och vissa metaller.
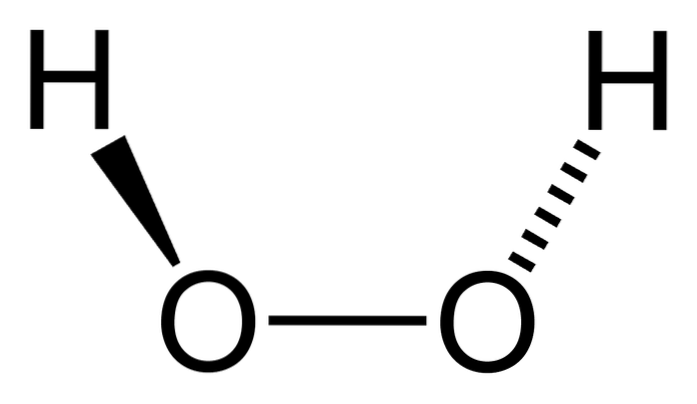
Det är en mycket användbar förening som används vid desinfektion av mindre sår, hårblekning, vattenbehandling etc. Även om det kan ha skadliga åtgärder för människor, finns det i alla eukaryota celler hos levande varelser, där det utför flera fördelaktiga funktioner.
Väteperoxid producerar oxidation av giftiga ämnen som fenoler, etanol, formaldehyd, etc., produkter som elimineras i levern och njurarna. Dessutom bidrar det till förstörelsen av bakterier fagocyterade av neutrofila leukocyter och makrofager..
Artikelindex
- 1 Struktur
- 1.1 Molekyl
- 1.2 Rotationer
- 1.3 Intermolekylära interaktioner
- 2 fastigheter
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Densitet
- 2.7 Smältpunkt
- 2.8 Kokpunkt
- 2.9 Löslighet i vatten
- 2.10 Löslighet
- 2.11 Fördelningskoefficient oktanol / vatten
- 2.12 Ångtryck
- 2.13 Dissociationskonstant
- 2,14 pH
- 2.15 Brytningsindex (nD)
- 2.16 Viskositet
- 2.17 Värmekapacitet
- 2.18 Förångningsvärme
- 2.19 Stabilitet
- 2.20 Korrosion
- 2.21 Sönderfall
- 2.22 Ytspänning
- 2.23 Reaktivitet
- 3 användningsområden
- 3.1 Blekning
- 3.2 Desinfektionsmedel
- 3.3 Tvättmedel
- 3.4 Kosmetisk applikation
- 3.5 Drivmedel
- 4 Skaffa
- 4.1 Hydrogenering
- 4.2 Filtrering
- 4.3 oxidation
- 4.4 Extraktion och rening
- 5 risker
- 6 Referenser
Strukturera
Molekyl
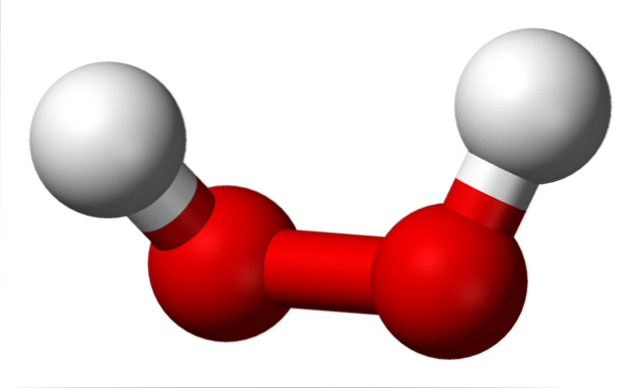
Den övre bilden visar strukturen för H-molekylentvåELLERtvå (H-O-O-H), med de röda sfärerna som motsvarar syreatomerna, och de vita väteatomerna. Observera att molekylen inte är platt och att H-atomerna inte förmörkas i rymden (den ena framför den andra).
Intressant att HtvåELLERtvå Det är svårt för den att rotera sin centrala enkla O-O-bindning, så positionerna för dessa H kan inte bytas ut; den ena går inte ner medan den andra går upp.
Varför? Eftersom det finns två fria elektronpar i de två syreatomerna, vilket ger totalt åtta mycket nära elektroner som stöter bort varandra på grund av deras negativa laddningar..
Rotationer
Ändå är O-O-bindningen mottaglig för lätt rotation på grund av interaktioner med omgivningen..
Till exempel, genom att föra samman de två tummarna, med pekfingrarna utsträckta och de andra stängda, som om de drar en domstol och sedan vrider tummarna på ett sådant sätt att en av pekfingrarna pekar framåt och den andra bakåt, kommer du att har en ungefärlig representation av HtvåELLERtvå.
Om en kropp rör vid något pekfinger kommer tummarna att rotera som svar på denna interaktion. emellertid kommer de omedelbart att återgå till sin ursprungliga position på grund av de elektroniska avstötningarna som nämns ovan. Dessa rotationer ramar således in de dynamiska aspekterna av denna molekyl.
Intermolekylära interaktioner
I flytande tillstånd HtvåELLERtvå lyckas etablera vätebindningar (HOOH-OtvåHtvå) eftersom annars den höga kokpunkten (150 ºC) jämfört med vatten inte skulle förklaras.
När den väl passerar in i gasfasen, H-molekylernatvåELLERtvå förmodligen kan det inte längre bilda sådana broar, inte bara på grund av det större intermolekylära avståndet, utan också väteatomerna skulle vara de första att röra vid kollisioner (detta kan visualiseras genom att använda fingermodellen igen).
Under den fasta fasen är vinkeln för de plan som upprättats av H 90 ° (sätt pekfingrarna vinkelrätt). Nu blir vätebindningar ännu viktigare och H-molekylertvåELLERtvå är anordnade i en kristall med tetragonal struktur.
Egenskaper
sFlaska med väteperoxid. På apotek uppnås det med en koncentration på 3% m / v. Källa: Pixnio.
Namn
-Väteperoxid
-Antioxidan
-Oxidanol
-Perhydroksyra
-O-hydroxiol
-Peroxid
Molmassa
34,0147 g / mol
Fysiskt utseende
Ljusblå (koncentrerad) eller färglös vätska. Det är lite mer visköst och tätare än vatten. Den destilleras för säkerhet vid låga temperaturer och under reducerat tryck, eftersom den bryts ned vid upphettning i explosiv form.
Odör
Skarp eller en ozonliknande lukt.
Smak
Bitter
Densitet
Fast 1,71 g / cm3
Densiteten för dess vattenlösningar beror på deras koncentration; till exempel, vid 27% har den en densitet av 1,10 g / cm3, medan den var 50% 1,13 g / cm3
Smältpunkt
- 0,43 ºC
Kokpunkt
150,2 ° C Detta värde har erhållits genom extrapolering eftersom väteperoxid sönderdelas vid höga temperaturer.
Vattenlöslighet
Blandbar ≥ 100 mg / ml vid 25 ºC
Löslighet
Det är lösligt i eter och alkoholer, men olösligt i petroleumeter. Sönderdelas i vatten och syre i många organiska lösningsmedel.
Fördelningskoefficient oktanol / vatten
Logg P = - 0,43
Ångtryck
5 mmHg vid 30 ºC.
Dissociationskonstant
pKa = 11,72
pH
Väteperoxidlösningar är svagt sura. Till exempel har en 35% en ett pH på 4,6; men genom att koncentrera sig till 90% blir pH mindre surt: 5.1.
Brytningsindex (nD)
1,4061
Viskositet
1245 cPoise vid 20 ºC.
Värmekapacitet
1267 J / gK (gas)
2619 J / gK (flytande)
Förångningsvärme
1,519 J / gK
Stabilitet
Stabil under rekommenderade förhållanden. Det stabiliseras ytterligare genom tillsats av acetanilid och tennsalter.
Korrosion
Frätande
Sönderfall
Det sönderdelas vid exponering för ljus eller i närvaro av oxiderande och reducerande ämnen. Det sönderdelas också vid uppvärmning. När det sönderdelas släpper det ut vatten och syre och gynnas av en ökning av pH och temperatur, liksom av närvaron av enzymkatalaset..
Ytspänning
80,4 dyn / cm vid 20 ° C
Reaktivitet
HtvåELLERtvå Det fungerar som ett oxidationsmedel i sura lösningar av järn (Fetvå+) till järn (F3+); oxiderar också sulfitjonen (SO3två-till sulfatjon (SO4två-).
Det kan också fungera som ett reduktionsmedel i närvaro av basiska lösningar, vilket reducerar natriumhypoklorit (NaOCl) och kaliumpermanganat (KMnO4) med utsläpp av syre.
Applikationer
Blekning
Väteperoxid används i pappersindustrin vid massa och pappersblekning, som förbrukar större delen av sin årliga produktion.
Desinfektionsmedel
Väteperoxid är ett milt antiseptiskt medel för att förhindra infektion av små sår, skrapor och brännskador. Det används också som munvatten och för att lindra mild irritation i munnen på grund av närvaron av cancersår eller tandköttsinflammation..
Det används också för att desinficera ytor, kylskåpets inre, vatten och bekämpa överdriven bakterietillväxt i vattensystem och kyltorn. Väteperoxid frigör fria syreradikaler som bryter ner föroreningar.
Rengöringsmedel
Väteperoxid används vid tillverkning av tvättblekmedel, inklusive natriumperkarbonat. Denna förening är ett komplex av natriumkarbonat och väteperoxid som, när de löses i vatten, separeras i dess komponenter.
Kosmetisk applikation
Utspädd väteperoxid används vid hårblekning före färgning. Det används också för att bleka tänderna, liksom en del av en hemlagad tandkräm.
Drivmedel
Väteperoxid används som monopropellant eller oxiderande komponent i en bipropolent raket. Det sönderdelas släppande av syre och vatten, en egenskap som tillät dess användning som drivmedel.
Den pumpas in i en reaktionscell med närvaron av en katalysator som påskyndar nedbrytningen. Under detta produceras en vattenånga vid hög temperatur.
När ångan släpps ut genom ett gap ger den en impuls. V-80 ubåten, byggd 1940, använde syre genererat från väteperoxid i dess turbiner; kallade Walters turbinsystem.
Erhållande
Ursprungligen erhölls väteperoxid industriellt genom hydrolys av ammoniumpersulfat, [(NH4)tvåStvåELLER8] eller elektrolys av ammoniumbisulfat, NH4HSO4.
Väteperoxid erhålls för närvarande industriellt genom användning av antrakinon. Processen utförs i fyra steg: hydrogenering, filtrering, oxidation, extraktion och rening..
Hydrering
Alkylantrokinon hydreras genom att leda vätgas genom en hydrogenator laddad med aluminiumoxid och en liten mängd av katalysatorn (palladium). Temperaturen hålls vid 45 ° C under permanent omrörning.
Alkyldrokinon omvandlas till alkylantrahydrokinon och tetrahydroalkylantrahydrokinon, varvid den senare väljs för sin större bekvämlighet för följande förfaranden.
Filtrering
Lösningen innehållande den hydrerade antrakinonen filtreras för att avlägsna spår av katalysatorn som den kan innehålla..
Oxidation
Den filtrerade lösningen oxideras genom att luft passerar genom den och bildar väteperoxid med låg renhet..
Extraktion och rening
Lösningen med väteperoxiden passerar genom en vätskevätskextraktionskolonn. Vattnet rinner genom kolonnen medan lösningen med väteperoxid pumpas genom den.
Vattnet når extraktorns botten med en väteperoxidkoncentration mellan 25 och 35% vikt / vikt. Därefter renas den genom vakuumdestillation till en väteperoxidkoncentration på 30%. Slutligen stabiliseras och lagras.
Risker
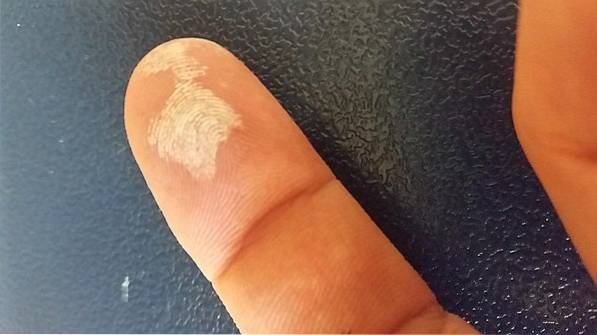
Väteperoxid är ett frätande ämne, så vid hudkontakt orsakar det allvarlig irritation, liksom en tillfällig vitare (bilden ovan). Det kan också orsaka ögonskador, klåda, utslag, rodnad och blåsor..
Inandning orsakar irritation i näsa, hals och lungor. Under tiden kan upprepad exponering orsaka bronkit, hosta, slem och andfåddhet. Och som om det inte var tillräckligt genererar det också huvudvärk, yrsel, illamående och kräkningar.
Allvarlig exponering för väteperoxid kan orsaka vätska att byggas upp i lungorna, så kallat lungödem - ett allvarligt tillstånd som kräver omedelbar läkarvård..
Arbetsmiljöverket (OSHA) har fastställt det högsta tillåtna för väteperoxid på 1 ppm i en arbetsmiljö i en 8-timmars skift. Eftersom det är en mutagen förening bör exponeringen dock hållas på ett minimum..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Väteperoxid. Återställd från: en.wikipedia.org
- William R. Busing och Henri A. Levy. (2004). Crystal and Molecular Structure of Hydrogen Peroxide: A Neutron - Diffraction Study. doi.org/10.1063/1.1696379
- Nationellt centrum för bioteknikinformation. (2019). Väteperoxid. PubChem-databas. CID = 784. Återställd från: pubchem.ncbi.nlm.nih.gov
- Redaktörerna för Encyclopaedia Britannica. (27 november 2018). Väteperoxid. Encyclopædia Britannica. Återställd från: britannica.com
- New Jersey Department of Health. (2016). Väteperoxid. [PDF]. Återställd från: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biokemi. Tredje upplagan. Utgivare Pearson Addison Wesley
- Web MD. (2019). Väteperoxid. Återställd från: webmd.com


Ingen har kommenterat den här artikeln än.