
Molar volymkoncept och formel, beräkning och exempel
De molär volym Det är en intensiv egenskap som anger hur mycket utrymme en mol av en viss substans eller förening upptar. Det representeras av symbolen Vm, y uttrycks i enheter av dm3/ mol för gaser och cm3/ mol för vätskor och fasta ämnen, eftersom de senare är mer begränsade av sina högre intermolekylära krafter.
Denna egenskap är återkommande när man studerar termodynamiska system som involverar gaser; eftersom, för vätskor och fasta ämnen, ekvationerna för att bestämma Vm de blir mer komplicerade och felaktiga. Därför, vad gäller grundläggande kurser, är molvolymen alltid associerad med den ideala gasteorin..
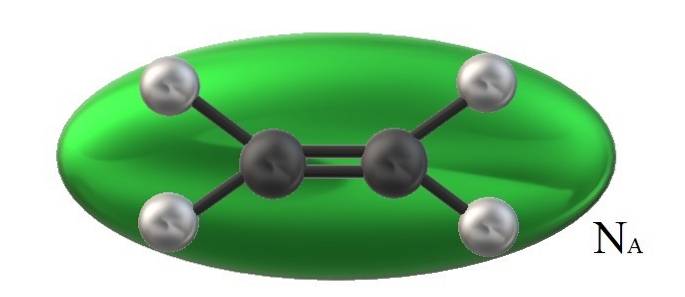
Detta beror på att strukturella aspekter är irrelevanta för ideala eller perfekta gaser; alla dess partiklar visualiseras som sfärer som elastiskt kolliderar med varandra och beter sig på samma sätt oavsett deras massa eller egenskaper.
Detta är fallet, en mol av vilken idealgas som helst kommer att uppta samma volym V. vid ett givet tryck och temperaturm. Det sägs sedan att under normala förhållanden av P och T, 1 atm respektive 0 ° C, kommer en mol av idealgas att uppta en volym på 22,4 liter. Detta värde är användbart och ungefärligt även vid utvärdering av verkliga gaser.
Artikelindex
- 1 Koncept och formel
- 1.1 För gaser
- 1.2 För vätskor och fasta ämnen
- 2 Hur man beräknar molvolym?
- 3 Exempel på beräkning av molvolym
- 3.1 Exempel 1
- 3.2 Övning 2
- 3.3 Övning 3
- 4 Referenser
Koncept och formel
För gaser
Den omedelbara formeln för att beräkna molens volym för en art är:
Vm = V / n
Där V är volymen den upptar, och n mängden av arten i mol. Problemet är att Vm beror på trycket och temperaturen som molekylerna upplever, och man önskar ett matematiskt uttryck som tar hänsyn till dessa variabler.
Etylen i bilden, HtvåC = CHtvå, den har en tillhörande molekylvolym begränsad av en grön ellipsoid. Denna HtvåC = CHtvå Den kan rotera på flera sätt, vilket är som om nämnda ellipsoid flyttades i rymden för att visualisera hur mycket volym den skulle uppta (uppenbarligen försumbar).
Men om volymen på en sådan grön ellipsoid multiplicerar vi den med NTILL, Avogadros nummer kommer vi då att ha en mol etylenmolekyler; en mol ellipsoider interagerar med varandra. Vid högre temperaturer kommer molekylerna att separeras från varandra; medan de är vid högre tryck kommer de att krympa och minska volymen.
Därför Vm är beroende av P och T. Etylen har en plan geometri, så man kan inte tro att dess Vm är exakt och exakt samma som för metan, CH4, av tetrahedral geometri och kan representeras med en sfär och inte en ellipsoid.
För vätskor och fasta ämnen
Molekylerna eller atomerna i vätskor och fasta ämnen har också sin egen Vm, som ungefär kan relateras till densiteten:
Vm = m / (dn)
Temperaturen påverkar molarvolymen för vätskor och fasta ämnen mer än tryck, så länge den senare inte varierar kraftigt eller är orimlig (i storleksordningen GPa). På samma sätt, som nämnts med eten, har geometrier och molekylstrukturer ett stort inflytande på värdena för Vm.
Under normala förhållanden observeras emellertid att densiteterna för olika vätskor eller fasta ämnen inte varierar för mycket i sin storlek; detsamma gäller sina molära volymer. Observera att ju tätare de är, desto mindre blir Vm.
När det gäller fasta ämnen beror deras molära volym också på deras kristallina strukturer (volymen på deras enhetscell)..
Hur man beräknar molvolym?
Till skillnad från vätskor och fasta ämnen, för ideala gaser finns det en ekvation som gör att vi kan beräkna Vm som en funktion av P och T och deras förändringar; detta är den för ideala gaser:
P = nRT / V
Vilket är tillmötesgående för att uttrycka V / n:
V / n = RT / P
Vm = RT / P
Om vi använder gaskonstanten R = 0,082 L atm K-1Mol-1, då bör temperaturerna uttryckas i kelvin (K) och trycken i atmosfärer. Observera att här kan vi se varför Vm är en intensiv egenskap: T och P har inget att göra med gasens massa utan med dess volym.
Dessa beräkningar är endast giltiga under förhållanden där gaser beter sig nära idealiteten. De värden som erhålls genom experiment har dock en liten felmarginal i förhållande till det teoretiska.
Exempel på beräkning av molvolym
Exempel 1
Det finns en gas Y vars densitet är 8,5 · 10-4 g / cm3. Om vi har 16 gram motsvarande 0,92 mol Y, beräkna dess molära volym.
Från densitetsformeln kan vi beräkna vilken volym av Y dessa 16 gram upptar:
V = 16 g / (8,5 10-4 g / cm3)
= 18,823,52 cm3 eller 18,82 L.
Så Vm Den beräknas direkt genom att dividera denna volym med antalet mol:
Vm = 18,82 L / 0,92 mol
= 20,45 L / mol eller L mol-1 eller dm3Mol-1
Övning 2
I det föregående exemplet på Y specificerades det inte vid någon tidpunkt vilken temperatur var som partiklarna i nämnda gas upplevde. Antag att Y arbetades vid atmosfärstryck, beräkna den temperatur som krävs för att komprimera den till den bestämda molära volymen.
Uttalandet om övningen är längre än dess resolution. Vi använder ekvationen:
Vm = RT / P
Men vi löser för T och med vetskap om att atmosfärstrycket är 1 atm löser vi:
T = VmP / R
= (20,45 L / mol) (1 atm) / (0,082 L atm / K mol)
= 249,39 K
Det vill säga en mol Y kommer att uppta 20,45 liter vid en temperatur nära -23,76 ºC.
Övning 3
Efter de tidigare resultaten, bestäm Vm vid 0 ºC, 25 ºC och vid absolut noll vid atmosfärstryck.
Omvandla temperaturerna till kelvin har vi först 273,17 K, 298,15 K och 0 K. Vi löser direkt genom att ersätta den första och andra temperaturen:
Vm = RT / P
= (0,082 L atm / K mol) (273,15 K) / 1 atm
= 22,40 L / mol (0 ºC)
= (0,082 L atm / K mol) (298,15 K) / 1 atm
= 24,45 L / mol (25 ° C)
Värdet 22,4 liter nämndes i början. Observera hur Vm ökar med temperaturen. När vi vill göra samma beräkning med absolut noll snubblar vi över termodynamikens tredje lag:
(0,082 L atm / K mol) (0 K) / 1 atm
= 0 L / mol (-273,15 ºC)
Gas Y kan inte ha en obefintlig molvolym; det betyder att den har omvandlats till en vätska och den tidigare ekvationen är inte längre giltig.
Å andra sidan är det omöjligt att beräkna Vm vid absolut noll följer den termodynamikens tredje lag, som säger att det är omöjligt att kyla något ämne till temperaturen absolut noll.
Referenser
- Ira N. Levine. (2014). Principer för fysikalisk kemi. Sjätte upplagan. Mc Graw Hill.
- Glasstone. (1970). Avhandling om fysisk kemi. Andra upplagan. Aguilar.
- Wikipedia. (2019). Molar volym. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (8 augusti 2019). Molar Volymdefinition i kemi. Återställd från: thoughtco.com
- BYJU'S. (2019). Molar volymformel. Återställd från: byjus.com
- González Monica. (28 oktober 2010). Molar volym. Återställd från: quimica.laguia2000.com



Ingen har kommenterat den här artikeln än.