
Natriumoxid (Na2O) struktur, formel, egenskaper, risker

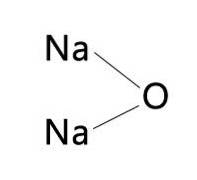
De natriumoxid är en oorganisk förening med formeln NatvåO. Liksom alla alkalimetalloxider har den en kristallin struktur som liknar antifluorit (liknar fluorit, CaF2, men med omvända katjoner och anjoner) motsvarande ansiktscentrerad kubik. (Natrium: dinatriumoxid, 1993-2016).
Man kan säga att natriumoxid är anhydrid av natriumhydroxid, eftersom den reagerar med vatten för att bilda två mol av denna förening på följande sätt:
NatvåO + HtvåO → 2NaOH
Generellt kan namnet KNaO hittas skrivet, med hänvisning till natriumoxid eller kaliumoxid. Detta beror på att de två oxiderna har liknande egenskaper vad gäller färg och expansions- och kontraktionshastigheter..
Olösliga källor till natriumoxid innehåller ofta spår av kaliumoxid, till exempel i fältspat (figur 2), som är den viktigaste källan till natrium i vissa emaljer (Britt, 2007).

Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 3 användningsområden
- 4 Referenser
Fysiska och kemiska egenskaper
Natriumoxid är ett vitt kristallint fast ämne (figur 3). Den har en molekylvikt på 61,98 g / mol, har en densitet på 2,27 g / ml och en smältpunkt på 1275 ° C..
Föreningen har en kokpunkt på 1950 ° C där den börjar sönderdelas till natriumperoxid och metalliskt natrium, men en intressant egenskap är dock att natriumoxid börjar sublimera vid 1100 ° C (National Center for Biotechnology Information, SF).

Reagerar våldsamt med vatten och alkohol för att bilda natriumhydroxid. Natriumoxid, NatvåEller absorberar det vändbart väte (Htvå), för att bilda natriumhydrid (NaH) och natriumhydroxid (NaOH), som har potential att hitta sin tillämpning på den reversibla lagringen av väte.
Reaktivitet och faror
Natriumoxid är en stabil icke-brandfarlig förening, men den kan reagera våldsamt med syror och vatten. Det kan också öka förbränningen av andra ämnen. Det klassificeras som frätande och kan bränna huden och ögonen (Royal Society of Chemistry, 2015).
Lösningen i vatten är en stark bas, eftersom den reagerar våldsamt med syror som är frätande. Att reagera våldsamt med vatten ger natriumhydroxid och attackerar många metaller i närvaro av vatten.
Ämnet är också frätande för andningsorganen och vid förtäring. Inandning av aerosol kan orsaka lungödem (National Institute for Occupational Safety and Health, 2014).
Vid inandning ska den drabbade personen flyttas till en sval plats. Om offret inte andas ska artificiell andning ges. Senare gå eller konsultera en läkare så snart som möjligt.
Vid hudkontakt ska förorenade kläder och skor avlägsnas omedelbart och tvättas med mycket vatten..
Vid kontakt med ögonen, skölj med mycket vatten i minst 15 minuter och kontakta läkare. Vid förtäring, framkalla inte kräkning, utan skölj munnen med vatten och kontakta läkare..
De viktigaste symptomen och effekterna kan vara: spasmer, inflammation och ödem i struphuvudet och bronkierna, lunginflammation, lungödem, brännande känsla, hosta, väsande andning, struphuvud och andningssvårigheter (natriumoxid (Na2O) (cas 1313- 59-3 ) Säkerhetsdatablad, 2010-2017).
Symtom på lungödem uppträder ofta inte på några timmar och förvärras av fysisk ansträngning. Vila och medicinsk observation är därför viktigt.
Natriumoxid bör förvaras på en torr plats och separeras från starka syror. Eftersom föreningen reagerar våldsamt med vatten bör vattenbaserade släckare eller sprinklers inte användas vid brand. Det rekommenderas att använda torrt pulver eller sand.
Applikationer
Huvudanvändningen av natriumoxid är vid tillverkning av glas. Det används i keramik och glas, men inte i rå form. Natriumoxid utgör i allmänhet cirka 15% av den kemiska sammansättningen av glas.
Det minskar temperaturen vid vilken kiseldioxid smälter (70% glaskomposition), vilket resulterar i att det är billigare och mer effektivt att producera glas, eftersom det kräver mindre energiförbrukning av tillverkaren (George Sumner, nd).
Natriumkalkglas är den vanligaste formen av framställt glas, som innehåller cirka 70% kiseldioxid (kiseldioxid), 15% soda (natriumoxid) och 9% kalk (kalciumoxid), med mycket högre mängder. Små av andra föreningar.
Natriumoxiden fungerar som ett flöde för att sänka temperaturen vid vilken kiseldioxiden smälter, och kalk fungerar som en stabilisator för kiseldioxiden. Natriumkalkglas är billigt, kemiskt stabilt, rimligt hårt och extremt användbart, eftersom det kan mjukas upp flera gånger om det behövs..
Dessa egenskaper gör den lämplig för tillverkning av ett brett utbud av glasprodukter, inklusive glödlampor, glas, flaskor och konstföremål..
Å andra sidan innehåller natriumoxid och kiseldioxid vattenkristall, även kallad natriumsilikat eller vattenglas, som bildar ett glasigt fast ämne med den mycket användbara egenskapen att vara löslig i vatten..
Glas vatten säljs som fasta klumpar eller pulver eller som en klar, sirapaktig vätska. Den används som en bekväm natriumkälla för många industriprodukter som: en byggare i tvättmedel, som bindemedel och lim, som flockningsmedel i vattenreningsverk och i många andra applikationer (Enciclopaedia britannica, 2017).
Oxidföreningar leder inte elektricitet. Vissa strukturerade oxider av perovskit är emellertid elektroniska ledare för applicering i katoden av fasta oxidbränsleceller och syregenereringssystem (American Elements, 1998-2017)..
Referenser
- National Institute for Occupational Safety and Health. (2014, 1 juli). CDC-NATRIUMOXID. Återställd från cdc.
- Amerikanska element. (1998-2017). Natriumoxid. Återställd från americanelements.com.
- Britt, J. (2007). Den kompletta guiden för hög eldglaser. New York: Lark Books.
- Britannica uppslagsverk. (2017). Natriumoxid kemisk förening. Återställd från britannica.com.
- George Sumner, D. J. (s.f.). Vad är några av användningsområdena för natriumoxid? Återställd från quora.com.
- Nationellt centrum för bioteknikinformation. (S.F.). PubChem Compound Database; CID = 73971. Återställd från pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natriumoxid. Återställd från chemspider.com.
- Ruitao Wang, T. K. (2006). Reaktion av väte med natriumoxid: Ett reversibelt hydrerings- / dehydrogeneringssystem. Journal of Power Sources, Volym 155, nummer 2, 167-171. sciencedirect.com.
- Natriumoxid (Na2O) (cas 1313-59-3) MSDS. (2010-2017). Återställd från guidechem: guidechem.com.
- Natrium: dinatriumoxid. (1993-2016). Återställd från webbelement: webelements.com.


Ingen har kommenterat den här artikeln än.