
Pauling skala elektronegativitet och energidifferens

De Pauling-skala är en godtycklig skala som används i kemi för att uttrycka elektronnegativitet av elementen. Detta definieras som tendensen hos en viss atom att attrahera elektroner i kombination med en annan atom.
I denna mening tenderar element med hög elektronegativitet att lätt få elektroner. Dessa är icke-metaller, medan det för sin del är mindre elektronegativa element som metaller, det är lättare att ge upp elektroner.
Man känner därför till elementets elektronegativitet och har en uppfattning om vilken typ av bindning som den kan bilda när den kombineras med en annan. Vi kommer att se detta med ett numeriskt exempel senare..
Med denna information kan många av de egenskaper som en förening kommer att förutsägas, något mycket användbart i experimentell kemi och för materialvetenskap, där nya föreningar kontinuerligt skapas..
Det är emellertid bekvämt att klargöra att trots hur viktigt det är finns det inget enda sätt att bestämma elektronegativitet; Pauling-skalan är bara ett av de olika sätt som föreslås för att hitta den, även om den är en av de mest använda.
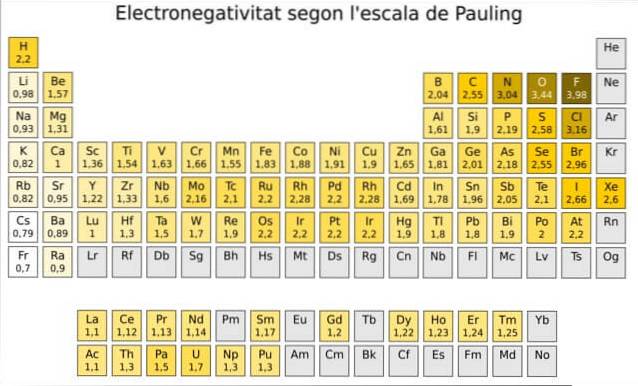
Faktum är att Paulings är en godtycklig skala där ett numeriskt värde tilldelas varje element i det periodiska systemet, vilket återspeglar dess elektronegativitet. Vi ser det i figur 1, där vi har elektronegativiteten för varje element, som tilldelats av den tvåfaldiga nobelpristagaren Linus Pauling (1901-1994) omkring 1939.
Artikelindex
- 1 Elementens elektronegativitet
- 1.1 Elektronegativitet i det periodiska systemet
- 2 Bindande energidifferens
- 2.1 Ekvationer för elektronegativitet
- 3 Exempel
- 3.1 Lösning
- 4 Referenser
Elementens elektronegativitet
Pauling, tillsammans med Don M. Yost, fann elektronegativitetsvärdena empiriskt genom experimentella data erhållna genom att mäta bindningsenergier..
Pauling tilldelade elementet fluor - över och till höger om tabellen i figur 1 - den högsta elektronegativiteten, med siffran 4.0. Så när fluor bildar bindningar uppvisar det den högsta tendensen att locka elektroner av alla element..
För det andra är syre med 3,5 och tredje är kväve med 3,0. Båda är placerade högst upp och till höger om bordet.
Å andra sidan, motsatt yttersta, är det minst elektronegativa elementet cesium, vars symbol är Cs, belägen till vänster om bordet, till vilket Pauling tilldelade siffran 0,7.
Elektronegativitet i det periodiska systemet
Generellt och som kan ses i figur 1 ökar elektronegativiteten -och joniseringsenergin från vänster till höger i det periodiska systemet. Den allmänna trenden indikerar också en minskning när man går från topp till botten.
Därför kommer vi att ha de mest elektronegativa elementen i det övre högra hörnet av tabellen: fluor, syre, klor, kväve. Den minst elektronegativa - eller den mest elektropositiva om du föredrar - finns till vänster: litium, natrium, kalium och de andra elementen i grupp 1 - kolumnen längst till vänster, motsvarande alkali- och jordalkalimetallerna.-.
I varje kolumn minskar elektronegativiteten när elementets atomnummer ökar, förutom övergångsmetallerna i mitten, som inte följer denna trend..
En viktig punkt att notera är att elektronegativitet är relativ, det är inte en oföränderlig egenskap hos varje element, och det mäts bara med avseende på andra element. Det beror mycket på oxidationstillståndet, så samma element kan uppvisa olika elektronegativitet, beroende på vilken typ av förening det bildar..
Bindande energidifferens

I kemi är en bindning det sätt som atomer, samma eller olika, sammanfogar för att bilda molekyler. Mellan atomerna visas krafter som håller dem samman på ett stabilt sätt.
Det finns flera typer av länkar, men här övervägs två:
-Kovalent, där atomer med liknande elektronegativiteter delar ett par elektroner.
-Joniskt, frekvent mellan atomer med olika elektronegativiteter där elektrostatisk attraktion råder.
Antag att två element A och B kan bilda molekyler med varandra, betecknade AA och BB. Och att de också kan gå samman för att bilda en AB-förening, allt genom någon typ av bindning.
Tack vare deltagandet av intermolekylära krafter finns det energi i bindningen. Till exempel är energin i bindningen AA EAA, i obligation BB är det EBB och slutligen i förening AB är det E.AB.
Om molekylen AB bildades av en kovalent bindning är teoretiskt bindningsenergin genomsnittet för energierna E.AA och EBB:
OCHAB = ½ (EAA + OCHBB)
Pauling beräknade EAB för olika föreningar mätte han det experimentellt och bestämde skillnaden mellan båda värdena, som han kallade Δ:
Δ = | (EAB) uppmätt - (EAB) teoretisk | = | (EAB) uppmätt - ½ (EAA + OCHBB) |
Pauling resonerade så här: om Δ är mycket nära 0 betyder det att elektronegativiteterna för båda elementen är lika och bindningen som förenar dem är kovalent. Men om Δ inte är liten, är bindningen mellan A och B inte ren kovalent.
Ju större absolutvärdet för A är, desto större är skillnaden mellan elektronegativiteten för elementen A och B och därför blir bindningen som förenar dem av jontyp. Senare kommer läsaren att hitta ett exempel där, genom att beräkna A, är det möjligt att bestämma typen av bindning av en förening.
Ekvationer för elektronegativitet
Förutsatt att skillnaden i energi är signalen som skiljer bindningens natur, utförde Pauling många experiment som ledde honom till att skapa ett empiriskt uttryck för de relativa elektronegativiteterna av två element A och B som bildar en molekyl..
Pauling betecknade denna elektronegativitet som χ (grekisk bokstav "chi") och definierade Δ enligt följande:
Ftvå· A = [χ (A) - χ (B)]två
χ (A) - χ (B) = f√Δ = 0,102√Δ
Observera att Δ är en positiv kvantitet. Faktorn f = 0,102 som visas genom att multiplicera kvadratroten av Δ är omvandlingsfaktorn mellan kJ (kilojoule) och eV (elektronvolt), båda enheterna energi.
Om istället kilokalorier och elektronvolter används uttrycks skillnaden i elektronegativiteter med en liknande formel men med f = 0,208:
χ (A) - χ (B) = 0,208√Δ
Pauling började med att tilldela väte ett värde på 2,1, ett tidigare värde erhållet av kemist Robert Mulliken. Han valde detta element som utgångspunkt eftersom det bildar kovalenta bindningar med många andra..
Med hjälp av ovanstående ekvation fortsatte han med att tilldela relativa värden till resten av elementen. Han insåg alltså att elektronegativiteten ökar när man flyttar från vänster till höger och uppifrån och ner i det periodiska systemet, som beskrivs i föregående avsnitt..
Exempel
Nedan följer en lista med element: N, J, Y och M och deras respektive elektronegativiteter Χ enligt Pauling-skalan:
-N: Χ = 4.0
-J: Χ = 1,5
-Y: Χ = 0,9
-M: Χ = 1,6
Bland följande föreningar bildade med dem:
YJ, YN, MN och JM
Ange den med den högsta joniska karaktären och den vars natur är kovalent. Anledning till ditt svar.
Lösning
Enligt de kriterier som fastställts av Pauling kommer föreningen med störst jonisk karaktär att vara den med den största skillnaden mellan elektronegativiteter och därmed ett större värde av Δ. För sin del är föreningen med den minsta energidifferensen den med en kovalent bindning.
Sedan beräknar vi hur mycket Δ är värd för varje förening, enligt följande:
Komposit YJ
A = [χ (Y) - χ (J)]två = (0,9 - 1,5)två = 0,36
Komposit YN
A = [χ (Y) - χ (N)]två = (0,9 - 4,0)två = 9,61
Komposit MN
A = [χ (M) - χ (N)]två = (1,6 - 4,0)två = 5,76
Komposit JM
A = [χ (J) - χ (M)]två = (1,5 - 1,6)två = 0,01
Av de tidigare resultaten följer det att den joniska föreningen är YN, vars Δ = 9,61, medan den kovalenta föreningen är JM, med Δ = 0,01.
Referenser
- Kemi Libretexts. Pauling elektronegativitet. Återställd från: chem.libretexts.org.
- IUPAC guldbok. Elektronnegativitet. Återställd från: goldbook.iupac.org.
- Salas-Banuet, G. Den missförstådda elektronegativiteten. Återställd från: scielo.org.
- Vetenskapliga texter. Elektronnegativitet. Återställd från: textscientificos.com.
- Whitten, K. 2010. Kemi. 9: e. Ed. Brooks / Cole. Cengage Learning.
- Wikipedia. Kovalent bindning. Återställd från: es.wikipedia.org.
- Wikipedia. Joniskt band. Återställd från: es.wikipedia.org.
Ingen har kommenterat den här artikeln än.