
Plumbous oxid (PbO) formel, egenskaper, risker och användningar

De lodrost, Bly (II) oxid eller blymonoxid är en kemisk förening med formeln PbO. Det finns i två polymorfer: litarge och masikotit. Dess struktur illustreras i figur 1.
Med återgång till komposition är litar den oxiderade produkten av smält bly som har omrörts eller finfördelats för att införliva luft, sedan kyld och mald för att bilda det gula pulvret..
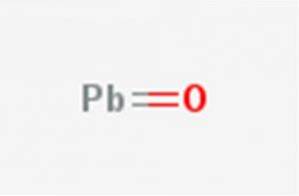
Namnet masikotit används både för det inhemska mineralet och för blymonoxidprodukten som produceras genom upphettning av blykarbonat till 300 ºC (Blymonoxid, 2016). Dessa mineraler visas i figur 2.

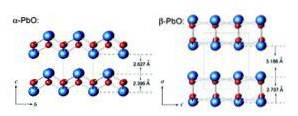
Masikotit har en ortorombisk struktur medan litarge har en tetragonal kristallstruktur. Bly (II) oxid har förmågan att ändra struktur när den värms eller kyls. Dessa strukturer visas i figur 3.
PbO produceras genom oxiderande metalliskt bly. Metallen smälts för att göra blytabletter och sedan mals de mellan 170 ~ 210 ° C och passeras genom lågan för oxidation vid temperaturer över 600 ℃. Oxidprodukterna krossas för att erhålla den färdiga blyoxiden (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO produceras i stor skala som en mellanprodukt vid raffinering av blymalmer till metallbly. Blymineral som används är galena (bly (II) sulfid). Vid hög temperatur (1000 ° C) omvandlas sulfiden till oxid enligt följande:
2PbS + 3O2 → 2PbO + 2SO2
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos lodrost
- 2 Reaktivitet och faror
- 3 användningsområden
- 4 Referenser
Plumbous oxid fysikaliska och kemiska egenskaper
Blymonoxid kan uppvisa två olika utseende: som ett gult torrt pulver med en ortorhombisk struktur (masikotit) eller som en rödaktig tetragonal kristall (litar). Båda vägarna illustreras i figur 4.

Föreningen har en molekylvikt av 223,20 g / mol och en densitet av 9,53 g / ml. Den har en smältpunkt på 888 ° C och en kokpunkt på 1470 ° C (National Center for Biotechnology Information, S.F.).
Föreningen är mycket dåligt löslig i vatten och kan lösa upp bara 0,0504 gram per liter vid 25 ° C i form av masikotit och 0,1065 gram per liter vid 25 ° C i form av litar. Föreningen är också olöslig i alkohol. Det är lösligt i ättiksyra, utspädd HNO3 och alkalier (Royal Society of Chemistry, 2015).
Föreningen är ett svagt oxidations- eller reduktionsmedel, men redoxreaktioner kan fortfarande förekomma. Dessa föreningar är inte reaktiva mot vatten.
Blyoxid oxiderar aluminiumkarbid med glöd vid upphettning. Blandningar av blyoxid med aluminiumdamm (som med andra metaller: natrium, zirkonium) ger en våldsam explosion.
Reaktivitet och faror
Blymonoxid är en förening som klassificeras som giftig. Ämnet är giftigt för centrala nervsystemet och kan vara cancerframkallande hos människor (Säkerhetsdatablad Blyoxid, gul, 2013).
Det tidiga förgiftningssymptomet är blylinjer som uppträder på tandköttets kant och huden blir grå. Neurasthenic syndrom kommer också att uppstå under den första perioden av envenomation..
Cerebellär förgiftning kan leda till blyförgiftningsdepression, blyförgiftningsmani, liksom blytoxicitet och känslighet för multipel neuritförlamning.
Blyförgiftning kan också orsaka hypokrom anemi och endokrina och metaboliska störningar. Dessutom kan blyförgiftning hämma aktiviteten hos vissa enzymer i matsmältningssystemet och orsaka matsmältningsbesvär, svår buksmärta och leverskador. Det kan också orsaka högt blodtryck och ökat kolesterol..
Om det finns allvarliga buksmärtor kan vissa åtgärder vidtas, såsom subkutan injektion av atropin och andra läkemedel, het buk, lavemang, varmt bad och så vidare. Den högsta tillåtna koncentrationen i luften är 0,01 mg / m3 (Blymonoxid, 2016).
Vid kontakt med ögonen eller med huden ska den tvättas med mycket vatten. Vid inandning eller förtäring ska offret föras till en ventilerad plats. Kräkningar bör inte induceras. Om offret inte andas, bör återupplivning från mun till mun ges.
I alla fall bör omedelbar läkarvård sökas. Blymonoxid är en skadlig förening för miljön, bioackumuleringen av denna kemikalie kan förekomma i växter och däggdjur.
Det rekommenderas starkt att detta ämne inte kommer ut i miljön, så det måste hanteras och lagras enligt de fastställda bestämmelserna (National Institute for Occupational Safety and Health, 2015).
Applikationer
Blymonoxid har använts som färgtork och som lågt brandflöde vid tillverkning av keramik och glas. Blykristallglas används vid tillverkning av högkvalitativa porslin.
Med användning av blymonoxid som ett flöde är det möjligt att få ett glas med högt brytningsindex och därmed önskad ljusstyrka (British Encyclopedia, 2016).
Semi-metalliska keramiska ledare har de högsta konduktiviteterna av alla keramik utom superledande. Blyoxid är ett exempel på denna typ av halvmetallkeramik. Dessa material har överlappande elektronenergiband och är därför utmärkta elektroniska ledare (Mason, 2008).
Blyoxid används huvudsakligen i elektronrör, bildrör, optiskt glas, röntgenblyglas och strålningsbeständigt gummi..
Det används som ett analytiskt reagens, silikatflödet, men också för utfällning av aminosyror
Blyoxid används vid tillverkningen av PVC-plaststabilisator och är också råmaterialet för andra blysalter. Det används också vid raffinering av petroleum och för bestämning av guld och silver..
Det används också som ett gult pigment i färger och emaljer. Masikotit användes som ett pigment av konstnärer från 1400- till 1700-talen.
Tunna skikt av blymonoxid används för att producera skimrande färger i mässing och brons. Litharge blandas med glycerol för att göra rörmokarens cement.
Referenser
- Encyclopedia Britannica. (2016, 10 oktober). Glas. Återställd från britannica: britannica.com.
- Kirk-Othmer. (nittonhundranittiofem). Encyclopedia of Chemical Technology. 4: e upplagan Volymer 1. New York: John Wiley and Sons.
- Blymonoxid. (2016, 1 maj). Återställd från cameo.mfa: cameo.mfa.org.
- Blymonoxid. (2016). Återställd från kemikaliebok: chemicalbook.com.
- Mason, T. O. (2008, 12 mars). Ledande keramik. Återställd från britannica: britannica.com.
- Säkerhetsdatablad Blyoxid, gul. (2013, 21 maj). Återställd från sciencelab: sciencelab.com.
- Nationellt centrum för bioteknikinformation. (S.F.). PubChem Compound Database; CID = 14827. Återställd från PubChem: pubchem.ncbi.nlm.nih.gov.
- National Institute for Occupational Safety and Health. (2015, 22 juli). Bly (II) OXID. Återställd från cdc.gov: cdc.gov.
- Royal Society of Chemistry. (2015). Bly (II) oxid. Återställd från chemspider: chemspider.com.


Ingen har kommenterat den här artikeln än.