
Aluminiumacetat (Al (CH3COO) 3) struktur, egenskaper, användningsområden

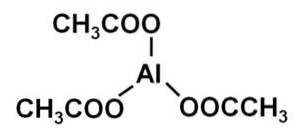
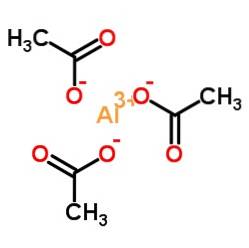
De aluminiumacetat är en organisk förening bildad av en aluminiumjon Al3+ och tre acetatjoner CH3KUTTRA-. Dess kemiska formel är Al (CH3KUTTRA)3. Det är också känt som aluminiumtriacetat. Det är ett lite hygroskopiskt vitt fast ämne och lösligt i vatten..
För att erhålla denna förening måste helt vattenfria betingelser användas, det vill säga fria från vatten, annars kan aluminiumdiacetatet Al (OH) (CH3KUTTRA)två.
Aluminiumacetatlösningar har antibakteriella och antifungala egenskaper, vilket är anledningen till att de sedan 1800-talet har använts för att behandla öroninfektioner..
Den mest kända är Burows lösning, utformad av en tysk läkare. Emellertid har dess användning ibland lett till skada på mellanörat..
Denna lösning har också använts för att behandla hudproblem som klåda och utslag. Det används till och med som solskyddsmedel.
Aluminiumacetat och dess derivat används för att erhålla mycket små strukturer eller partiklar av aluminiumoxid AltvåELLER3. Dessa strukturer eller nanopartiklar kan vara i form av löv, blommor eller nanorör..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Löslighet
- 3.4 Kemiska egenskaper
- 3.5 Övriga egenskaper
- 4 Skaffa
- 5 Användningar inom medicin
- 5.1 Öroninfektioner
- 5.2 Hudsjukdomar
- 6 Andra användningsområden
- 6.1 Avbruten användning
- 7 skadliga effekter
- 8 Referenser
Strukturera
Aluminiumtriacetat består av en aluminiumkatjon Al3+ och tre acetatanjoner CH3KUTTRA-. Det är aluminiumsaltet av ättiksyra CH3COOH.
Aluminium är bundet till acetatanjoner genom deras syre. Med andra ord är den fäst vid tre oxygener. Dessa korsningar är joniska.
Nomenklatur
- Aluminiumacetat
- Aluminiumtriacetat
- Aluminiumetanoat
- Burows lösning (översättning från engelska Burows lösning): Det är en lösning av aluminiumacetat.
Egenskaper
Fysiskt tillstånd
Fast vit.
Molekylvikt
204,11 g / mol
Löslighet
Lösligt i vatten.
Kemiska egenskaper
I vattenlösning löses aluminiumtriacetat och tenderar att bilda diacetat Al (OH) (CH3COO) och ibland Al (OH) monoacetattvå(CH3KUTTRA). Allt beror på pH och mängden ättiksyra CH3COOH närvarande i lösningen.
Al (CH3KUTTRA)3 + HtvåO ^ Al (OH) (CH3KUTTRA)två + CH3COOH
Al (CH3KUTTRA)3 + 2 timmartvåO ⇔ Al (OH)två(CH3COO) + 2 CH3COOH
Andra egenskaper
Aluminiumacetat är något hygroskopiskt, det vill säga det absorberar vatten från luften.
Erhållande
Aluminiumacetat erhålls företrädesvis under strikt vattenfria betingelser, det vill säga i total frånvaro av vatten. Detta inkluderar också frånvaron av luft, eftersom den kan innehålla fukt..
Värm en blandning av isättika CH3COOH och ättiksyraanhydrid (CH3CO)tvåEller under sådana förhållanden att allt närvarande vatten kan elimineras. Aluminiumklorid AlCl tillsätts till denna heta blandning.3 vattenfritt fast ämne (utan vatten).
Ett vitt fast ämne av Al (CH3KUTTRA)3.
AlCl3 + 3 CH3COOH → Al (CH3KUTTRA)3 + 3 HCl
Den totala frånvaron av vatten är viktig för att undvika bildning av salter av aluminiummonoacetat Al (OH)två(CH3COO) och aluminiumdiacetat Al (OH) (CH3KUTTRA)två.
Det kan också erhållas genom reaktion av aluminiumhydroxid Al (OH)3 och ättiksyra CH3COOH.
Användningar inom medicin
Öroninfektioner
Aluminiumacetat har använts sedan 1800-talet för att behandla otit, vilket är en inflammation i yttre eller mellanörat som vanligtvis åtföljs av infektion. Dess användning beror på dess antibakteriella och svampdödande effekt.
Det har använts i form av en 13% aluminiumacetatlösning, ursprungligen utformad av den tyska läkaren Karl August von Burow, varför det kallas Burows lösning..
Det har befunnits hämma tillväxten av mikroorganismer som vanligen förekommer i otitis media eller externa, såsom otitis media. Pseudomonas aeruginosa, de Staphylococcus aureus och den Proteus mirabilis.

Det finns dock de som rapporterar att dessa lösningar kan vara skadliga för örat. Vissa djurstudier undersöker dess toxiska effekter på örat men har rapporterat motstridiga resultat..
Vissa forskare rekommenderar att inte använda aluminiumacetat när trumhinnan är perforerad, eftersom det har observerats utöva en inflammatorisk effekt på mellanörat.
Hudsjukdomar
Burows lösning används som en antiseptisk, sammandragande och som en aktuell lösning för att behandla allvarliga utslag, dermatit, inflammation, klåda, sveda och solbränna. Har en lugnande och irritationsreducerande effekt.
Andra användningsområden
Aluminiumtriacetat och dess derivat används för många kvalitativa och kvantitativa kemiska experiment.
Ett derivat av aluminiumtriacetat, Al (OH) (CH3KUTTRA)två även kallat aluminiumhydroxidacetat, det används som en föregångare för att erhålla nanostrukturer av gamma-aluminiumoxid (γ-AltvåELLER3).
I detta fall betyder prekursor att γ-Al-nanostrukturerna framställs av aluminiumdiacetat (erhållet på ett visst sätt).tvåELLER3, och detta uppnås genom att värma upp det till mycket höga temperaturer.
Nanostrukturer är mycket små partiklar som endast kan observeras genom speciella mikroskop som elektronmikroskop. Med aluminiumacetat som föregångare har γ-Al-nanostrukturer erhållitstvåELLER3 liknar löv, blommor, fibrer och till och med nanorör.

Avbruten användning
I början av 1900-talet användes aluminiumacetat som konserveringsmedel i livsmedel som korvkonserver.
En aluminiumacetatlösning framställdes genom blandning av aluminiumsulfat Altvå(SW4)3, kalciumkarbonat CaCO3, ättiksyra CH3COOH och vatten HtvåEller, och det tillsattes maten.
När denna lösning kommer i kontakt med köttet fixeras aluminium i dess beståndsdelar i form av en förening som är olöslig i kokande vatten, men som upplöses i magsaft cirka 80%.
Redan 1904 var det känt att aluminiumsalter minskar matsmältningen, både i magen och i tarmarna. Därför är det en oönskad metod att tillsätta aluminiumacetatlösningar till konserver..

Skadliga effekter
Eftersom det finns studier som rapporterar att aluminiumacetat kan vara giftigt har test utförts där laboratoriemöss har injicerats med aluminiumacetat.
Resultaten indikerar att denna förening orsakar skada på ryggraden hos nämnda djur, såväl som skador på kromosomerna och spermierna hos djuren. Med andra ord är det genotoxiskt.
Detta varnar dig för de potentiella hälsorisker som kan orsakas av överexponering för aluminiumacetat och för den försiktighet som ska vidtas när du använder det..
Referenser
- Mac-Kay Chace, E. (1904). Användningen av basisk aluminiumacetat som konserveringsmedel i korv. Journal of the American Chemical Society 1904, 26, 6: 662-665. Återställd från pubs.acs.org.
- Hood, G.C. och Ihde, A.J. (1950). Aluminiumacetater och propionater - deras beredning och sammansättning. Journal of the American Chemical Society 1950, 72, 5: 2094-2095. Återställd från pubs.acs.org.
- Pitaro, J. et al. (2013). Ototoxicitet av aluminiumacetat / bensentoniumklorid Otisk lösning i Chinchilla Animal Model. Laryngoskop, 2013; 123 (10): 2521-5. Återställd från ncbi.nlm.nih.gov.
- Thorp, M.A. et al. (2000). Burows lösning vid behandling av aktiv slemhinna kronisk suppurativ otitis media: bestämning av en effektiv utspädning. The Journal of Laryngology & Otology, juni 2000, Vol. 114, sid 432-436. Återställd från ncbi.nlm.nih.gov.
- D'Souza, herr P. et al. (2014). Bedömning av genotoxicitet hos aluminiumacetat i benmärg, manliga könsceller och fosterleverceller hos schweiziska albinomöss. Mutationsforskning 766 (2014) 16-22. Återställd från ncbi.nlm.nih.gov.
- Basal, Y. et al. (2015). Effekterna av aktuella Burows och Castellanis lösningar på mellanörsmukosa hos råttor. J. Int Adv Otol 2015; 11 (3): 253-6. Återställd från advancedotology.org.
- USA National Library of Medicine. (2019). Aluminiumacetat. Återställd från pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. och Leffler, S.M. (2012). Solbränna. Vad ska man göra. In Minor Emergencies (tredje upplagan). Återställd från sciencedirect.com.
- Thompson, E. och Kalus, A. (2017). Akuta hudreaktioner och bakterieinfektioner. Behandling. I resehandboken och tropisk medicinhandbok (femte upplagan). Återställd från sciencedirect.com.
- Kim, T. et al. (2010). Morfologisk kontrollerbar syntes av gamma-aluminiumoxid-nanostrukturer via en jonisk vätskeassisterad hydrotermisk väg. Crystal Growth & Design, Vol. 10, nr 7, 2010, s. 2928-2933. Återställd från pubs.acs.org.
- Rajala, J.W. et al. (2015). Core-Shell Electrospun Hollow Aluminium Oxide Ceramic Fibers. Fibrer 2015, 3, 450-462. Återställd från mdpi.com.



Ingen har kommenterat den här artikeln än.