
EMB agarfundament, beredning och användning
De EMB-agar är ett selektivt och differentierat fast odlingsmedium som används för isolering av gramnegativa baciller, huvudsakligen av Enterobacteriaceae-familjen, och andra icke-snabba gramnegativa baciller. Det är också känt av akronymen EAM, som står för eosin-metylenblått..
Detta medium skapades av Holt-Harris och Teague 1916. Det innehåller pepton, laktos, sackaros, dikaliumfosfat, agar, eosin, metylenblått och vatten. Det liknar mycket MacConkey Agar, speciellt när man använder Levines modifierade EMB-agar, som inte innehåller sackaros.
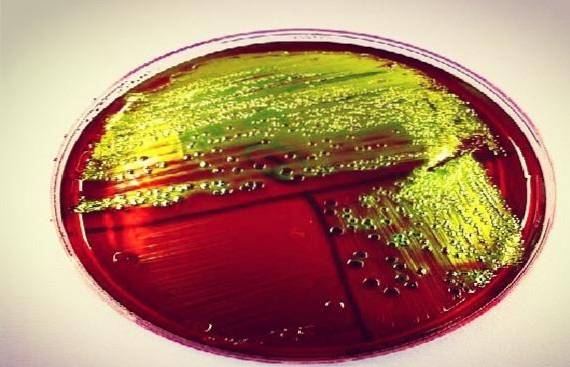
I själva verket bestämmer varje laboratorium om de ska arbeta med det ena eller det andra, eftersom de har samma funktion, även om de är biokemiskt olika..
Det har till och med samma nackdel som klassisk MacConkey-agar när det gäller produktion av släktet Proteus. För att undvika detta fenomen kan agarkoncentrationen därför ökas med upp till 5%..
Artikelindex
- 1 Motivering
- 1.1 Selektiv
- 1.2 Differential
- 2 Förberedelse
- 3 användningsområden
- 4 Kvalitetskontroll
- 5 Slutliga överväganden
- 6 Referenser
Grund
Selektiv
EMB-agar är subtilt selektiv eftersom den innehåller anilinfärgämnena (eosin och metylenblått), som fungerar som hämmare, vilket förhindrar tillväxten av de flesta Gram-positiva bakterierna och några snabba Gram-negativa stavar..
Denna agar har dock nackdelen att vissa Gram-positiva bakterier kan motstå närvaron av hämmande ämnen och växa som små färglösa exakta kolonier, såsom Enterococcus faecalis och lite Stafylokock.
Vissa jästar kan också växa, t.ex. Candida albicans-komplex, vilket ger mycket små rosa kolonier. Chlamydosporer kan till och med utvecklas från denna jäst om provet är djupt utsäde..
Differentiell
Å andra sidan är EMB-agar också ett differentiellt medium, eftersom dessa färgämnen tillsammans (eosin och metylenblått) har egenskapen att bilda en fällning vid surt pH, därför fungerar de som indikatorer för dess produktion..
Således producerar svagt laktos- eller sackarosjäsande bakterier lila kolonier inom 24 till 48 timmar. Till exempel släktena Klebsiella, Enterobacter och Serratia.
De bakterier som starkt jäser laktos, såsom Escherichia coli, eller sackaros, som Yersinia enterocolitica eller Proteus penneri, bildar en grön-svart fällning, vilket ger ett karakteristiskt metalliskt glansutseende hos dessa arter.
Det bör noteras att om EMB-levinmedium (utan sackaros) används, Yersinia enterocolitica Y Proteus penneri kommer att producera tydliga kolonier.
Bakterier som inte jäser laktos eller sackaros får näring av närvaron av peptoner som ger de aminosyror och kväve som behövs för bakterietillväxt och ger tydliga kolonier. Till exempel släktena Salmonella och Shigella, bland andra.
Likaså är det viktigt att notera att släktet Acinetobacter kan presentera lavendelblå kolonier, även om det inte är en laktosjäser eller sackaros utan har egenskapen att fixera metylenblått på sin cellvägg. Detta kan också hända med andra oxidativa bakterier.
Förberedelse
Det ursprungliga uttorkade mediet har ljusbeige färg.
För att bereda detta odlingsmedium måste 36 gram av det uttorkade mediet vägas och suspenderas i en kolv innehållande en liter destillerat vatten..
Efter att ha låtit blandningen vila i 5 minuter, ta kolven till en värmekälla, blanda kraftigt och ständigt tills den kokar och löser sig helt..
Därefter måste det redan upplösta odlingsmediet steriliseras med hjälp av autoklaven vid 121 ° C i 15 minuter..
I slutet av tiden tas den bort från autoklaven och får vila kort. Sedan, fortfarande varm (45-50 ° C), serveras 15-20 ml agar i varje steril petriskål. Mediet ska vara lakmusblått.
Efter servering lämnas plattorna lätt täckta tills agaren svalnat något. De täcks sedan och får stelna helt. Därefter beställs de i inverterade tallrikshållare och förvaras i kylskåp (8 ° C) tills de används..
Denna procedur utförs företrädesvis i en laminär flödeskåpa eller framför Bunsen-brännaren för att undvika kontaminering.
Det är viktigt att komma ihåg att varje kommersiellt hus anger mängden som ska vägas för att förbereda odlingsmediet..
Mediets slutliga pH måste vara 7,2 ± 0,2
Applikationer
Detta medium används för att så urin och avföring eller någon typ av kliniskt prov, särskilt om det finns misstankar om förekomsten av icke-snabba gramnegativa baciller, såsom bacillerna som tillhör Enterobacteriaceae-familjen, som växer mycket bra på detta medium..
Enteropatogena bakterier av släktena Shigella och Salmonella kännetecknas av sina färglösa eller något bärnstensfärgade kolonier.
Andra icke-laktosjäsande basiller växer också såsom Aeromonas, Pseudomonas, Acinetobacter, bland andra..
På samma sätt är detta medium mycket användbart i mikrobiologisk analys av mat och vatten, eftersom det är idealiskt för den fullständiga bekräftande fasen för bestämning av koliforma, det vill säga att bekräfta närvaron av E coli från grumliga EC-buljonger, från den mest troliga taltekniken (MPN).
QA
För att verifiera att det nylagade odlingsmediet fungerar bra kan kontrollstammar planteras för att observera koloniens egenskaper och verifiera att de ger som förväntat..
För detta, ATCC-stammar eller väl identifierade stammar av E coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa och vissa Gram-positiva bakterier, såsom S. aureus.
Det förväntas att E coli Skapa välutvecklade blåsvarta kolonier med grön metallisk glans. Medan, Enterobacter aerogenes Y Klebsiella sp de bör ge välutvecklade blåsvarta slemhinnekolonier.
För hans del, Salmonella typhimurium Y Shigella flexneri, bör utveckla stora, färglösa eller något bärnstensfärgade kolonier.
Äntligen genren Pseudomonas aeruginosa växer som färglösa kolonier av oregelbunden storlek, medan grampositiva bakterier bör hämmas helt eller växa glest med mycket små kolonier.
Slutgiltiga tankar
Ibland gör sterilisering att metylenblått minskar och visar en orange färg. För att metylenblått ska oxidera och återfå den lila färgen, måste den blandas försiktigt tills färgen återhämtas..
Efter sterilisering kan också färgämnet fällas ut, så det måste blandas väl innan servering av petriskålarna..
Referenser
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B och Velázquez O. 2009. Tekniker för mikrobiologisk analys av livsmedel. 2: a upplagan Kemiska fakulteten, UNAM. Mexiko.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Karakterisering och fördelning av stammar av Escherichia coli Potentiellt patogent isolerat från slaktkycklingar från fjäderfägårdar i Peru. Pastor investiga. veterinär. Peru 2012 23 (2): 209-219. Tillgänglig på: scielo.org.
- Laboratorios Conda S.A. Eosin och metylenblå agar. 2010. Tillgänglig på: condalab.com
- Britannia Laboratories. Levine E.M.B (With Eosin and Methylene Blue) 2011.Tillgänglig på: britanialab.com
- BD Laboratories. BD EMB Agar (Eosin Methylen Blue Agar), modifierad. 2013. Tillgänglig på: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. (5: e upplagan). Argentina, Ledare Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnos. 12 utgåva Argentina. Redaktionellt Panamericana S.A



Ingen har kommenterat den här artikeln än.