
Müeller Hinton agarfundament, beredning och användningsområden
De Müeller Hinton agar Det är ett fast, icke-selektivt näringsmedium som består av köttinfusion, syrakaseinpepton, stärkelse, agar och destillerat vatten. Detta medium möjliggör utmärkt mikrobiell tillväxt av de flesta snabbt växande bakterier.
Det skapades ursprungligen av John Howard Müeller och Jane Hinton för att isolera näringskrävande bakterier som Neisseria gonorrhoeae Y Neisseria meningitidis. På grund av dess egenskaper visade det sig dock vara idealiskt för studier av känslighet för antibiotika, vilket gav tillförlitliga och reproducerbara resultat..
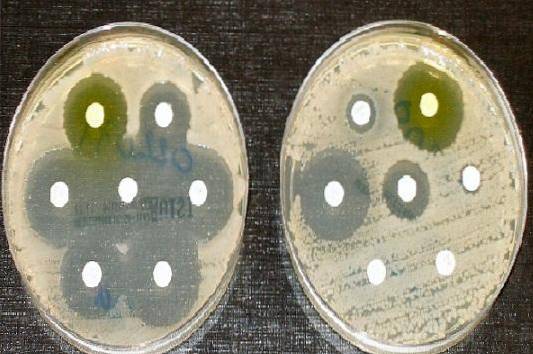
Därför är Müeller Hinton agar det odlingsmedium som godkänts av Clinical and Laboratory Standards Institute (CLSI) och Europeiska kommittén för antimikrobiell känslighetstestning för utförandet av det antimikrobiella mottaglighetstestet med Kirby diskdiffusionsmetod och Bauer.
Artikelindex
- 1 Motivering
- 2 Förberedelse
- 3 användningsområden
- 3.1 Antibiogramtekniken
- 3.2 Strategisk placering av skivor på Müeller Hinton-agar
- 4 Orsaker till felaktiga resultat
- 5 Begränsning
- 6 Kvalitetskontroll
- 7 Referenser
Grund
Att vara ett icke-selektivt näringsmedium är det utmärkt för tillväxt av de flesta patogena bakterier..
Å andra sidan gör dess enkla sammansättning att ämnena lätt diffunderar på den, vilket är en väsentlig egenskap för känslighetstestet med skivdiffusionsmetoden..
En annan av dess egenskaper är att den innehåller en liten mängd hämmare, vilket gör att sulfonamider, trimetoprim och tetracykliner kan utvärderas effektivt..
Man måste dock komma ihåg att mediet måste uppfylla vissa villkor för att säkerställa att det fungerar korrekt, inklusive:
Justering av pH, agarets djup och lämplig koncentration av tymin, tymidin, Ca++, Mg++ och Zn++.
Du måste också veta att metoden är standardiserad och därför måste alla parametrar uppfyllas, till exempel:
Inokulumkoncentrationen, koncentrationen och konserveringen av antibiotikaskivorna, placeringen av lämpligt antal skivor på agaren, avståndet mellan en skiva och en annan, strategisk placering av vissa antibiotika, atmosfären, temperaturen och tiden för inkubation.
Förberedelse
Väg upp 37 g avtorkat Müeller Hinton-medium och lös upp i 1 liter destillerat vatten. Värm mediet under omrörning för att underlätta upplösningen. Koka i 1 minut.
Autoklav för att sterilisera vid 121 ° C i 15 minuter. Vid borttagning från autoklaven ska kolven placeras i ett vattenbad vid 50 ° C för att svalna. Häll 25 till 30 ml i sterila petriskålar med 10 cm diameter.
Plattorna bör ha en genomsnittlig tjocklek på 4 mm (idealisk), med ett intervall på 3-5 mm.
Om det är önskvärt att bereda blodagar med Müeller Hinton-agar som bas, häll 5% sterilt och defibrinerat lammblod innan det serveras på tallrikarna..
Mediets slutliga pH bör vara mellan 7,2 och 7,4.
Investera och förvara i kylskåp tills användning. Låt plattan nå rumstemperatur före användning.
Färgen på det beredda mediet är ljusbeige.
Applikationer
Används för att utföra antibiogram eller antibiotikamottagningstest för de flesta snabbt växande icke-snabba patogener.
Om agaren kompletteras med blod, används den för att utföra antibiogrammet av krävande mikroorganismer som: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, bland andra. Det har också använts för att isolera Legionella pneumophila.
Antibiogramteknik
Innan antibiogrammet utförs måste en bakterielösning motsvarande 1,5 x 10 framställas.8 celler.
För detta tas 3 till 4 kolonier av den rena kulturen och suspenderas i en sojabönatryptikasbuljong eller i Müeller Hinton-buljong, inkuberas i 2 till 6 timmar och koncentrationen justeras med steril saltlösning, jämförande med en Mac Farland-standard på 0,5 %.
Om de kräver mikroorganismer kan kolonier suspenderas direkt upp till koncentrationen av 0,5% Mac Farland. Därefter sås Müeller Hinton-plattan med en pinne impregnerad med den beredda bakterielösningen..
För att göra detta doppas vattnet i lösningen och sedan avlägsnas överskottet av vätska genom att pressas mot rörets väggar. Omedelbart därefter förs vattpinnen över hela ytan och lämnar inga platser orörda, sedan roteras plattan något och sådd igen. Åtgärden upprepas ytterligare två gånger.
Låt stå i 10 minuter och fäst sedan antibiotikaskivorna med en steril pincett, lämna ett mellanrum på 24 mm. När du har placerat varje skiva på agaren trycker du lätt på varje skiva med tången för att säkerställa att de håller sig bra..
När processen är klar inverteras plattan och inkuberas vid 35-37 ° C i aerobios under 16 till 18 timmar. Om det är en krävande mikroorganism kan det motivera mikroaerofili och om antibiogrammet innehåller oxacillinskivor bör det läsas efter 24 timmar..
En linjal används för att mäta diametern på varje gloria. Resultaten bör registreras i mm. Därefter korreleras de erhållna värdena med skärpunkttabellerna som publiceras i den aktuella CLSI-handboken..

Rapportera som känsligt (S), mellanliggande (I) eller resistent (R), i förekommande fall.
Antibiotika väljs utifrån den isolerade mikroorganismen och den typ av infektion som orsakar.
Ibland måste den strategiska placeringen av antibiotika beaktas för att visa fenotypiska resistensmönster.
Strategisk placering av skivor på Müeller Hinton-agar
För enterobakterier ska klavulansyra-skivan placeras mot 3: e och 4: e generationens cefalosporiner. En äggformad breddning indikerar att stammen är en producent av beta-laktamaser (ESBL) med utökat spektrum. Detta innebär att patienten inte ska behandlas med några cefalosporiner..
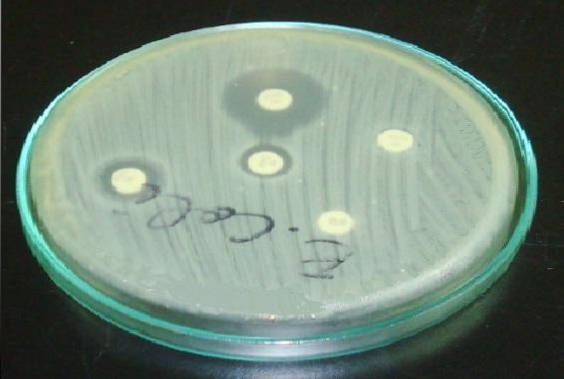
I Staphylococcus är det viktigt att placera erytromycin- eller azitromycin-skivan framför clindamycin-skivan (D-test).
En resistent halo i erytromycin och en utplattning i klindamycinhaloen indikerar att stammen har staminducerbar clindamycinresistens (ICR). Detta innebär att en behandling med klindamycin inte kommer att vara effektiv..
För att söka efter inducerbara AMP C-stammar i Enterobacteriaceae och vissa icke-jäsande gramnegativa stavar, står ceftazidime, cefoxitin eller piperacillin tazobactan-skivor mot en imipenem-skiva, på ett avstånd av 27 mm.
En tillplattad gloria i en av skivorna mot imipenem indikerar närvaron av inducerbar AMP C.
För sökandet efter konstitutiv C-AMP står en 500 µg cloxacillin-skiva inför ceftazidim (30 µg) och med cefotaxim (30 µg), på ett avstånd av 25 mm. En vidgad halo i någon av cefalosporinerna indikerar positivitet.
Cloxacillin-skivan kan också ersättas med en 9 mm-skiva av Whatman nr. 6 filterpapper impregnerad med fenylborsyra (400 | ig) med ett avstånd av 18 mm. Den tolkas på samma sätt som den föregående.
Slutligen, för att undersöka produktionen av metallobetalaktamaser, särskilt i Pseudomonas aeruginosa, En skiva impregnerad med 10 | il etylendiamintetraättiksyra (EDTA 750 | ig) och tioglykolsyra (SMA 300 | ig) används, som vetter mot imipenem- och meropenemskivorna, på ett avstånd av 15 mm.
Testet är positivt om imipenem- eller meropenemhalor utvidgas mot EDTA / SMA-skivan. Detta resultat måste bekräftas med det modifierade Hodge-testet..
Denna metod består av att inokulera en stam av Escherichia coli ATCC 25922 på Müeller Hinton-plattan. En skiva av imipenem placeras i mitten av plattan och sedan görs en strimma från skivan mot periferin med töjningen av P. aeruginosa misstänksam. Upp till fyra stammar kan testas per platta.
Testet kommer att vara positivt om det finns en zon med förvrängning av imipenem-halo runt sträckmärket.
Orsaker till felaktiga resultat
-Dåligt bevarade antibiotiska skivor kan ge falsk resistens. Exempelvis är oxacillindisken mycket sårbar för temperaturförändringar..
-Ett pH för mediet under det som anges (surt) ger mindre halor i aminoglykosider och makrolider (risk för falsk resistens) och större halor i penicillin, tetracyklin och novobiocin (risk för falsk känslighet).
-Om pH är över det angivna (alkaliskt) vänds effekterna som beskrivs ovan.
-Medier med förhöjda tymin- och tymidinkoncentrationer påverkar genom att signifikant reducera inhiberingshalorna av sulfonamider och trimetoprim..
-Höga koncentrationer av kalcium och magnesium ger falsk resistens hos aminoglykosider, polymyxin B och tetracykliner mot stammar av Pseudomonas aeruginosa.
-Låga koncentrationer av kalcium och magnesium ger falska känsligheter hos aminoglykosider, polymyxin B och tetracykliner mot stammar av Pseudomonas aeruginosa.
-Förekomsten av zink påverkar resultaten av karbapenemskivor (imipenem, meropenem och ertapenem).
-Medietjocklek under 3 mm ger falsk känslighet, medan tjocklek över 5 ger falskt motstånd.
-Mobilisering av skivor i antibiogrammet ger deformerade glorier, eftersom urladdningen av antibiotika är omedelbar.
- Mycket svaga ympningar påverkar resultaten, eftersom det inte kommer att finnas en enhetlig eller sammanflytande tillväxt i agaren, ett nödvändigt tillstånd för att kunna mäta inhiberingshalor, förutom att halor kan ge större än normalt.
-Alltför belastade ympningar kan ge mindre halor än normalt.
-Att inte respektera avståndet mellan skivor gör att en gloria överlappar varandra och de kan inte läsas korrekt.
-Inkubera med COtvå ökar storleken på haloerna av tetracyklin- och meticillinskivorna.
-Inkubera vid temperaturer under 35 ° C ger större halor.
-Tillsatsen av blod minskar sulfonamidhalogen.
Begränsning
Känsligheten hos ett antibiotikum som visas i antibiogrammet mot en mikroorganism (in vitro) är ingen garanti för att det fungerar in vivo.
QA
För att veta om mediet innehåller tillräcklig mängd tymin måste en stam odlas Enterococcus faecalis ATCC 29212 och testa känsligheten för trimetoprim sulfametoxazol (SXT), måste den ge en halo lika med eller> 20 mm för att vara tillfredsställande.
Referenser
- "Müller-Hinton agar." Wikipedia, den fria encyklopedin. 16 nov 2018, 12:23 UTC. 27 jan 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnos. 12 utgåva Redaktionellt Panamericana S.A. Argentina.
- Cona E. Förhållanden för en bra känslighetsstudie med agardiffusionstest. Rev Chil Infect, 2002; 19 (2): 77-81
- Difco Francisco Soria Melguizo Laboratory. Müeller Hinton agar med 5% fårblod. 2009. Tillgänglig på: http://f-soria.es
- BD Müeller Hinton II Agar Laboratory. 2017. Tillgänglig på: .bd.com
- Britannia Laboratories. Müeller Hinton agar. 2015.Tillgängligt på: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan Redaktionellt Panamericana S.A. Argentina.
- Martínez-Rojas D. AmpC-betalaktamaser: Allmänt och metoder för fenotypisk detektion. Pastor Soc. Ven. Mikrobiol. 2009; 29 (2): 78-83. Tillgänglig på: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Fenotypisk detektion av metallobetalaktamaser i kliniska isolat av Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Tillgänglig på: scielo.org.


Ingen har kommenterat den här artikeln än.