
Aluminiumbromidformel, egenskaper och användningsområden
De aluminiumbromid Det är en förening som består av en aluminiumatom och ett varierat antal bromatomer. Den bildas beroende på antalet valenselektroner som aluminium har.
Att vara en förening förenad av en metall (aluminium) och en icke-metall (brom) bildas kovalenta bindningar som ger strukturerna en mycket god stabilitet, men utan att nå en jonbindning..
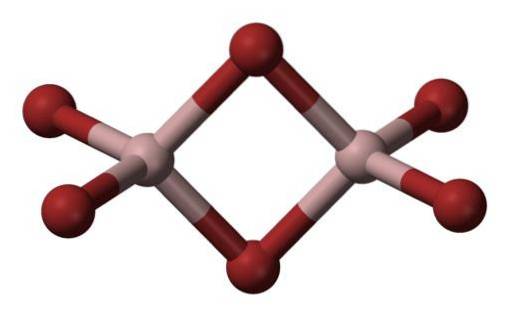
Aluminiumbromid är ett ämne som normalt förekommer i fast tillstånd med en kristallstruktur.
Färgerna på de olika aluminiumbromiderna framträder som bleka gula i olika nyanser och ibland utan synlig färg.
Färgen beror på föreningens ljusreflektionskapacitet och ändras beroende på de strukturer som skapas och de former som den tar..
Dessa föreningars fasta tillstånd kristalliserar, så de har väldefinierade strukturer med ett utseende som liknar havssalt men varierar i färg..
Formel
Aluminiumbromid består av en aluminiumatom (Al) och olika mängder bromatomer (Br), beroende på valenselektronerna som aluminium har..
Av denna anledning kan den allmänna formeln för aluminiumbromid skrivas enligt följande: AlBrx, där "x" är antalet bromatomer som binder till aluminium.
Den vanligaste formen i vilken den förekommer är som Al2Br6, som är en molekyl med två aluminiumatomer som strukturens huvudbaser..
Bindningarna mellan dem bildas av två brominer i mitten, så att varje aluminiumatom har fyra bromatomer i sin struktur, men i sin tur delar de två.
Egenskaper
På grund av sin natur är det mycket lösligt i vatten men det är också delvis lösligt i föreningar som metanol och aceton, till skillnad från andra typer av ämnen..
Den har en molekylvikt på 267 g / mol och bildas av kovalenta bindningar.
Natriumbromid når sin kokpunkt vid 255 ° C och når sin smältpunkt vid 97,5 ° C.
En annan egenskap hos denna förening är att den avger toxiner när den förångas, så det rekommenderas inte att arbeta med den vid höga temperaturer utan adekvat skydd och relevant säkerhetskunskap..
Applikationer
En av användningsområdena för denna typ av ämne på grund av dess metalliska och icke-metalliska natur är att ämnen i kemiska renhetsprov..
Renhetstestning är mycket viktigt för att bestämma kvaliteten på reagens och göra produkter som människor är nöjda med..
I vetenskaplig forskning används det på ett mycket varierande sätt. Till exempel för att bilda komplexa strukturer, medel vid syntes av andra värdefulla kemiska produkter, vid hydreringen av dihydroxinaftalener och i selektiviteten i reaktioner, bland andra användningsområden..
Denna förening är inte kommersiellt populär. Som framgår ovan har den vissa applikationer som är mycket specifika men mycket intressanta för det vetenskapliga samfundet..
Referenser
- Chang, R. (2010). Kemi (10: e upplagan) McGraw-Hill Interamericana.
- Krahl, T., & Kemnitz, E. (2004). Amorf aluminiumbromidfluorid (ABF). Angewandte Chemie - International Edition, 43(48), 6653-6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M., & Zakharova, O. (2007). Komplex av nitronaftoler med aluminiumbromid. Russian Journal of Applied Chemistry, 80(6), 1015-1017. doi: 10.1134 / S107042720706033X
- Koltunov, K. Y. (2008). Kondensation av naftalendioler med bensen i närvaro av aluminiumbromid: En effektiv syntes av 5-, 6- och 7-hydroxi-4-fenyl-1- och 2-tetraloner. Tetrahedron Letters, 49(24), 3891-3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P., & Knochel, P. (2010). Framställning av organoaluminiumreagens från propargyliska bromider och aluminium aktiverat av PbCl2 och deras region- och diastereoselektiva tillsats till karbonylderivat. Kemi - en europeisk tidskrift, 16(32), 9829-9834. doi: 10.1002 / chem.201000523
- Ostashevskaya, L. A., Koltunov, K. Y., & Repinskaya, I. B. (2000). Jonisk hydrering av dihydroxinaftalener med cyklohexan i närvaro av aluminiumbromid. Russian Journal of Organic Chemistry, 36(10), 1474-1477.
- Iijima, T. och Yamaguchi, T. (2008). Effektiv regioselektiv karboxylering av fenol till salicylsyra med superkritisk CO2 i närvaro av aluminiumbromid. Journal of Molecular Catalysis A: Chemical, 295(1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, V. B., Byrikhin, V. S., Nesmelov, A. I., Ezhova, E. A., & Orlinkov, A. V. (1998). 1H NMR spektroskopisk studie av tert-butylklorid - katjoniskt initieringssystem av aluminiumbromid. Russian Chemical Bulletin, 47(11), 2149-2154.


Ingen har kommenterat den här artikeln än.