
Värmeabsorberade formler, hur man beräknar det och lösta övningar
De absorberad värme Det definieras som överföring av energi mellan två kroppar vid olika temperaturer. Den med lägre temperatur absorberar värmen från den med högre temperatur. När detta händer ökar den termiska energin hos det ämne som absorberar värme och partiklarna som komponerar det vibrerar snabbare och ökar deras kinetiska energi..
Detta kan resultera i en temperaturökning eller en tillståndsförändring. Gå till exempel från fast till vätska, såsom is när den smälter i kontakt med vatten eller läsk vid rumstemperatur.

Tack vare värme är det också möjligt för objekt att ändra sina dimensioner. Termisk expansion är ett bra exempel på detta fenomen. När de flesta ämnen upphettas upplever de vanligtvis att deras dimensioner ökar.
Ett undantag från detta är vatten. Samma mängd flytande vatten ökar volymen när det svalnar under 4 ºC. Dessutom kan temperaturförändringar också förändras i densitet, något som också är mycket observerbart när det gäller vatten..
Artikelindex
- 1 Vad den består av och formler
- 1.1 Kalorier
- 2 Hur man beräknar det?
- 2.1 Energibalansen
- 3 Övningen löst
- 3.1 Tillvägagångssätt
- 3.2 Uppgifter
- 4 Referenser
Vad den består av och formler
När det gäller energi under transport är enheterna av absorberad värme Joule. Men under lång tid hade värmen sina egna enheter: kalorin.
Än idag används denna enhet för att kvantifiera energiinnehållet i mat, även om en kalori i kosten motsvarar en kilokalori värme.
Kalorier
Kalorin, förkortad som kalk, är den mängd värme som behövs för att höja temperaturen på 1 gram vatten med 1 ºC.
På 1800-talet utförde Sir James Prescott Joule (1818 - 1889) ett berömt experiment där han lyckades omvandla mekaniskt arbete till värme och uppnå följande ekvivalens:
1 kalori = 4,166 Joule
I brittiska enheter kallas värmeenheten Btu (Brittisk termisk enhet), vilket definieras som den mängd värme som behövs för att höja temperaturen på ett kilo vatten med 1ºF.
Likvärdigheten mellan enheterna är som följer:
1 Btu = 252 kalorier
Problemet med dessa äldre enheter är att värmemängden beror på temperaturen. Det vill säga den som krävs för att gå från 70 ° C till 75 ° C är inte densamma som den som krävs för att till exempel värma vattnet från 9 ° C till 10 ° C..
Det är därför som definitionen överväger väldefinierade intervall: från 14,5 till 15,5 ° C och 63 till 64 ° F för kalorin respektive Btu..
Vad beror mängden absorberad värme på?
Mängden absorberad värme som ett material tar upp beror på flera faktorer:
- Massa. Ju större massa, desto mer värme kan den absorbera.
- Ämnets egenskaper. Det finns ämnen som, beroende på deras molekylära eller atomstruktur, kan absorbera mer värme än andra..
- Temperatur. För att få högre temperatur krävs att man tillför mer värme.
Mängden värme, betecknad som F, den är proportionell mot de beskrivna faktorerna. Därför kan det skrivas som:
Q = m.c.AT
Var m är objektets massa, c är ett ständigt samtal specifik värme, en inneboende egenskap hos ämnet och ΔT är den temperaturvariation som uppnås genom att absorbera värme.
AT = TF - Teller
Denna skillnad har ett positivt tecken, eftersom man förväntar sig att när man absorberar värme TF > Teller. Detta inträffar såvida inte ämnet genomgår en fasförändring, såsom vatten som går från vätska till ånga. När vatten kokar förblir temperaturen konstant vid cirka 100 ºC, oavsett hur snabbt det kokar..
Hur man beräknar det?
Genom att sätta två föremål vid olika temperaturer i kontakt, når de båda en termisk jämvikt. Då utjämnas temperaturerna och värmeöverföringen upphör. Detsamma händer om mer än två objekt kommer i kontakt. Efter en viss tid kommer de alla att ha samma temperatur.
Förutsatt att föremålen i kontakt bildar ett slutet system, från vilket värme inte kan komma ut, gäller principen om energibesparing, så det kan sägas att:
F absorberad = - Q gav
Detta representerar en energibalans som liknar en persons inkomster och kostnader. Av denna anledning har den överförda värmen ett negativt tecken, eftersom den slutliga temperaturen för det objekt som ger efter är lägre än den ursprungliga. Därför:
AT = TF - Teller < 0
Q-ekvationen absorberad = - Q gav den används när två objekt är i kontakt.
Energi balans
För att genomföra energibalansen är det nödvändigt att särskilja föremålen som absorberar värme från de som ger efter, och sedan:
Σ Fk= 0
Det vill säga summan av energivinst och -förlust i ett slutet system måste vara lika med 0.
Ett ämnes specifika värme
För att beräkna mängden absorberad värme är det nödvändigt att känna till den specifika värmen för varje deltagande ämne. Detta är den mängd värme som krävs för att höja temperaturen på 1 g material med 1 ° C. Dess enheter i det internationella systemet är: Joule / kg. K.
Det finns tabeller med den specifika värmen för många ämnen, vanligtvis beräknade med en kalorimeter eller liknande verktyg..
Ett exempel på hur man beräknar materialets specifika värme
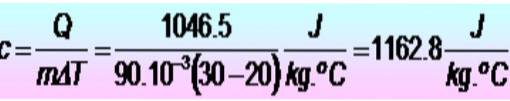
250 kalorier krävs för att höja temperaturen på en metallring från 20 till 30 ºC. Om ringen har en massa av 90 g. Vad är metallens specifika värme i SI-enheter??
Lösning
Enheter omvandlas först:
Q = 250 kalorier = 1046,5 J
m = 90 g = 90 x 10-3 kg
Övningen löst
En aluminiumkopp innehåller 225 g vatten och en 40 g kopparrörare, allt vid 27 ° C. Ett silverprov på 400 g vid en initial temperatur på 87 ° C placeras i vattnet.
Omröraren används för att omröra blandningen tills den når sin slutliga jämviktstemperatur på 32 ° C. Beräkna aluminiumkoppens massa, med tanke på att det inte finns några värmeförluster för miljön.
Närma sig
Som nämnts ovan är det viktigt att skilja mellan föremål som ger upp värme och de som absorberar:
- Aluminiumkopp, kopparrörare och vatten absorberar värme.
- Silverprov ger värme.
Data
De specifika värmerna för varje ämne levereras:
- Silver: c = 234 J / kg. ºC
- Koppar: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Vatten c = 4186 J / kg. ºC
Värmen som absorberas eller överförs av varje ämne beräknas med hjälp av ekvationen:
Q = m.c.λT
Lösning
Silver
F gav = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Rör av koppar
F absorberad = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
Vatten
F absorberad = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Aluminiummugg
F absorberad = m aluminium . 900 x (32 - 27) J = 4500 .m aluminium
Användning av:
Σ Fk= 0
77,4 + 4709,25 + 4500 .m aluminium = - (-5148)
Slutligen rensas aluminiummassan:
m aluminium = 0,0803 kg = 80,3 g
Referenser
- Giancoli, D. 2006. Fysik: principer med tillämpningar. 6th. Ed Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fysik: En titt på världen. 6ta Förkortad upplaga. Cengage Learning. 156 - 164.
- Rex, A. 2011. Grundläggande fysik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Volym 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage Learning. 362 - 374



Ingen har kommenterat den här artikeln än.