
Värmegivna formler, hur man beräknar det och lösta övningar
De värme gav är överföring av energi mellan två kroppar vid olika temperaturer. Den med högsta temperaturen ger upp värmen till den vars temperatur är lägre. Oavsett om en kropp ger upp eller absorberar värme, kan dess temperatur eller dess fysiska tillstånd variera beroende på massan och egenskaperna hos det material som den är tillverkad av..
Ett bra exempel är i en ångande kopp kaffe. Metallskeden med vilken sockret rörs om värms upp. Om den lämnas kvar i koppen tillräckligt länge kommer kaffe och en metallsked att utjämna temperaturerna: kaffet har svalnat och skeden har gett värme. En del värme kommer att ha gått in i miljön, eftersom systemet inte är isolerat.

När temperaturen utjämnades, termisk jämvikt.
Om du gjorde samma test med en plastsked, skulle du säkert märka att det inte värms upp så snabbt som metall, men så småningom kommer det också att komma i balans med kaffe och allt runt det..
Detta beror på att metall leder bättre värme än plast. Å andra sidan ger kaffe säkert värme i en annan takt än varm choklad eller annan dryck. Så värmen som ges eller absorberas av varje objekt beror på vilket material eller ämne det är gjort av..
Artikelindex
- 1 Vad den består av och formler
- 1.1 Temperaturskillnaden ΔT
- 1.2 Ämnets specifika värme- och värmekapacitet
- 2 Hur man beräknar det?
- 2.1 Kalorimetri
- 3 Lösta övningar
- 3.1 Övning 1
- 3.2 Övning 2
- 4 Referenser
Vad den består av och formler
Värme avser alltid flöde eller transitering av energi mellan ett objekt och ett annat på grund av temperaturskillnaden.
Det är därför vi talar om överförd värme eller absorberad värme, eftersom genom att tillsätta eller extrahera värme eller energi på något sätt är det möjligt att ändra temperaturen på ett element.
Mängden värme som det hetaste objektet avger kallas vanligtvis Q. Detta värde är proportionellt mot massan av objektet. En kropp med stor massa kan ge mer värme än en annan med lägre massa..
Temperaturskillnad AT
En annan viktig faktor vid beräkning av den värme som frigörs är skillnaden i temperatur som det objekt som frigör värmen upplever. Det betecknas som ΔT och det beräknas så här:
AT = TF - Teller
Slutligen beror mängden överförd värme också på objektets karaktär och egenskaper, som kvantitativt sammanfattas i en konstant som kallas specifik värme av materialet, betecknas som c.
Så slutligen är uttrycket för den överförda värmen följande:
Fgav = - m.c.AT
Att ge in symboliseras av ett negativt tecken.
Specifik värme- och värmekapacitet hos ett ämne
Specifik värme är den mängd värme som krävs för att höja temperaturen på 1 g ämne med 1 ºC. Det är en inneboende egenskap hos materialet. Dess enheter i det internationella systemet är: Joule / kg. K (Joule mellan kilogram x temperatur i grader Kelvin).
Värmekapacitet C är ett kopplat koncept, men något annorlunda, eftersom objektets massa är inblandad. Värmekapacitet definieras enligt följande:
C = mc
Dess enheter i S.I. de är Joule / K. Så den frigjorda värmen kan också uttryckas likvärdigt som:
Q = -C. ΔT
Hur man beräknar det?
För att beräkna värmen som avges av ett objekt är det nödvändigt att veta följande:
- Den specifika värmen för ämnet som ger upp värmen.
- Massan av nämnda ämne
- Den slutliga temperaturen som ska erhållas
Specifika värmevärden för många material har fastställts experimentellt och finns i tabeller.
Kalorimetri
Om detta värde inte är känt är det nu möjligt att få det med hjälp av en termometer och vatten i en värmeisolerad behållare: kalorimetern. Ett diagram över denna enhet visas i figuren som följer med övning 1.
Ett prov av ämnet vid en viss temperatur nedsänks i en tidigare uppmätt mängd vatten. Den slutliga temperaturen mäts och materialets specifika värme bestäms med de erhållna värdena..
Genom att jämföra resultatet med de tabellvärden kan det vara känt vilket ämne det är. Denna procedur kallas kalorimetri.
Värmebalansen utförs genom att spara energi:
F gav + F absorberad = 0
Lösta övningar
Övning 1
En kopparbit på 0,35 kg införs vid en temperatur av 150 ° C i 500 ml vatten vid en temperatur av 25 ° C. Hitta:
a) Den slutliga jämviktstemperaturen
b) Hur mycket värme som flyter i denna process?
Data
ckoppar = 385 J / kg. ºC
cvatten = 4180 J / kg. ºC
Vattentäthet: 1000 kg / m3
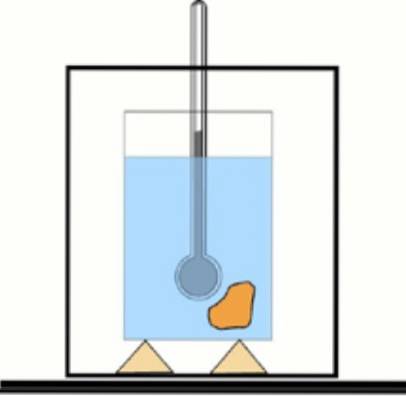
Lösning
a) Koppar ger upp värmen medan vatten absorberar den. Eftersom systemet anses vara stängt ingriper endast vattnet och provet i värmebalansen:
F gav = Q absorberad
Å andra sidan krävs det att massan av 500 ml vatten beräknas:
500 ml = 0,5 L = 0,0005 m3
Med dessa data beräknas vattnets massa:
massa = densitet x volym = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
Ekvationen för värmen i varje ämne höjs:
Fgav = -mkoppar . ckoppar. ΔT = -0,35 kg. 385 J / kg. ° C . (TF -150 ° C) = -134,75 (TF - 150) J
Fabsorberad = mVatten . cVatten. ΔT = 0,5 kg. 4186 J / kg. ºC. (TF -25 ºC) = 2093 (TF -25) J
Jämförelse av resultaten har vi:
2093 (TF - 25) = -134,75 (TF - 150)
Det är en linjär ekvation med en okänd vars lösning är:
TF = 32,56 ºC
b) Mängden värme som flyter är den värme som överförs eller den absorberade värmen:
F gav = - 134,75 (32,56 - 150) J = 15823 J
F absorberad = 2093 (32,56 - 25) J = 15823 J
Övning 2
En kopparbit på 100 g värms upp i en ugn vid temperaturen Teller och sedan införs den i en 150 g kopparkalorimeter som innehåller 200 g vatten vid 16 ºC. Den slutliga temperaturen en gång i jämvikt är 38 º C. När kalorimetern och dess innehåll vägs, visar man sig att de har avdunstat 1,2 g vatten Vad var initialtemperaturen Teller?
Data: den latenta förångningsvärmen för vatten är Lv = 2257 kJ / kg
Lösning
Denna övning skiljer sig från den tidigare, eftersom det måste beaktas att kalorimetern också absorberar värme. Värmen som släpps ut av kopparstycket investeras i allt följande:
- Värm upp vattnet i kalorimetern (200 g)
- Värm koppar som kalorimetern är tillverkad av (150 g)
- Avdunsta 1,2 gram vatten (energi behövs också för fasförändring).
Fgav = -100 x 1 x 10 -3 kg. 385 J / kg. ºC. (38 - Teller ) ºC = -38,5. (38 - Teller) J
F absorberas av kalorimeter = Q absorberas av vatten + F förångning + F absorberas av koppar
0,2 kg. 4186 J / kg ºC (38 - 16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg .385 J / kg .ºC (38 - 16 ºC) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
Därför:
-38,5. (38 - Teller) = 22397,3
Teller = 619,7 ºC
Värmen som behövdes för att få upp 1,2 g vatten upp till 100 ° C kunde också ha övervägt, men det är en ganska liten mängd i jämförelse..
Referenser
- Giancoli, D. 2006. Fysik: principer med tillämpningar. 6th. Ed Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fysik: En titt på världen. 6ta Förkortad upplaga. Cengage Learning. 156 - 164.
- Rex, A. 2011. Grundläggande fysik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Utg. Volym 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage Learning.



Ingen har kommenterat den här artikeln än.