
Natriumcyanid (NaCN) struktur, egenskaper, risker, användningar

De Natriumcyanid är ett oorganiskt salt bildat av en natriumkatjon Na+ och en cyanidanjon CN-. Dess kemiska formel är NaCN. Även känd som natriumcyanid, det är ett vitt kristallint fast ämne. Det är hygroskopiskt, det vill säga det absorberar vatten från miljön och dess kristaller är kubiska som natriumklorid NaCl.
När det är löst i vatten tenderar det att bilda vätecyanid HCN. Dess lösningar löser lätt guld och silver. Denna egenskap gör att den används för att extrahera guld och silver från sina mineraler. Lösningarna som används för detta ändamål återvinns, det vill säga de återanvänds flera gånger.

Men en del av cyaniden lyckas fly till vissa avfallsdammar, vilket utgör en fara för vilda djur och människor, eftersom cyanid är mycket giftigt och kan orsaka död..
NaCN används i den kemiska industrin som en mellanprodukt för att bereda olika typer av föreningar, såsom färgämnen, jordbrukskemikalier och läkemedel eller läkemedel..
Natriumcyanid är en mycket farlig förening eftersom den kan orsaka död, så den måste hanteras med extrem försiktighet.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Flampunkt
- 3.6 Densitet
- 3.7 Löslighet
- 3.8 Dissociationskonstant
- 3,9 pH
- 3.10 Kemiska egenskaper
- 4 risker
- 5 Skaffa
- 6 användningsområden
- 6.1 Vid utvinning av guld- och silvermineraler. Konsekvenser
- 6.2 Vid produktion av andra kemiska föreningar
- 6.3 Inom metallindustrin
- 6.4 Vid andra användningsområden
- 6.5 Utan användning, ifrågasatta eller mycket sällsynta applikationer
- 7 Referenser
Strukturera
Natriumcyanid består av en Na + -jon och en CN-jon-.
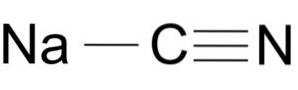
Cyanidjonen har en kolatom C och en kväveatom N kopplad till varandra genom en trippelbindning..
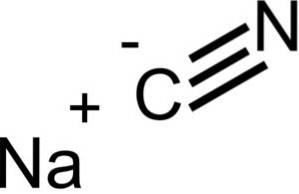
NaCN har samma kristallstruktur som NaCl, så dess kristaller är kubiska.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Egenskaper
Fysiskt tillstånd
Hygroskopisk vit kristallin fast substans (absorberar vatten från miljön).
Molekylvikt
49,007 g / mol
Smältpunkt
563,7 ºC
Kokpunkt
1496 ºC
Flampunkt
Det är inte brandfarligt. Men om de utsätts för en brand produceras HCN-vätecyanid och kväveoxider..
Densitet
1595 g / cm3 vid 20 ºC
Löslighet
Mycket löslig i vatten: 48 g / 100 ml vid 10 ° C, 82 g / 100 ml vid 35 ° C. Lätt löslig i alkohol
Dissociationskonstant
Det hydrolyseras i vattenlösning som genererar vätecyanid HCN. Konstanten för denna hydrolys är Kh = 2,5 x 10-5.
pH
Vattenhaltiga NaCN-lösningar är starkt alkaliska
Kemiska egenskaper
När den är upplöst i vatten separerar den sig i Na-joner+ och CN-. I vattenlösning cyanidjonen CN- ta ett proton H+ vatten HtvåEller bildar HCN och en OH-jon-, så att lösningen blir alkalisk.
CN- + HtvåO → HCN + OH-
Av denna anledning sönderdelas dess vattenlösningar snabbt vid förvaring och bildar väte-cyanid HCN..
Det är frätande mot aluminium. Dess lösningar löser lätt guld Au och silver Ag i närvaro av luft..
Det är ett kelatbildande medel sedan cyanidanjonen CN- kan lätt bindas till andra metaller, såsom silver, guld, kvicksilver, zink, kadmium, etc..
Har en svag bitter mandel lukt.
Risker
Det måste hanteras med stor försiktighet. Det är en mycket giftig förening, hämmar viktiga metaboliska processer och leder till död genom intag, inandning, absorption genom huden eller kontakt med ögonen..
Vid inandning löses NaCN upp i luftvägarnas slemhinna och passerar in i blodomloppet. Cyanidjonen av NaCN har en stark affinitet för järn i oxidationstillståndet av +3, det vill säga järnkatjonen Fe3+.
När cyanid absorberas reagerar det snabbt med Fe3+ av ett viktigt enzym i cellernas mitokondrier (cytokromoxidas), vilket förhindrar vissa processer för andning av detta.
Därför inhiberas eller saktas ner cellulär andning och cytotoxisk hypoxi resulterar. Det betyder att celler och vävnader inte kan använda syre, särskilt hjärnceller.
På detta sätt uppstår permanent eller dödlig skada på kroppen. Detta kan förekomma hos både människor och djur..
Om det intas, orsakar det trängsel i blodkärlen och korrosion i magslemhinnan, förutom ovan nämnda.

Det är inte brännbart, men vid kontakt med syror frigör det HCN som är mycket brandfarligt och giftigt.
Om det smälter med nitrit eller klorat kan det explodera.
Erhållande
Kan erhållas med natrium Na, ammoniak NH3 och kol C. Natrium reagerar med ammoniak för att ge natriumamid NaNHtvå:
2 Na + 2 NH3 → 2 NaNHtvå + Htvå↑
Natriumamid värms upp med kol till 600 ° C och producerar natriumcyanamid NatvåNCN, som sedan omvandlas till natriumcyanid med kol vid 800 ºC:
2 NaNHtvå + C → 2 Htvå↑ + NatvåNCN
NatvåNCN + C → 2 NaCN
En annan metod är att smälta kalciumcyanamid CaNCN och kol C med natriumkarbonat NatvåCO3:
CaNCN + C + NatvåCO3 → CaCO3 + 2 NaCN
Det kan också framställas genom att leda kvävgas Ntvå med en varm blandning av natriumkarbonat NatvåCO3 och pulverformigt kol C med järn Fe som katalysator eller reaktionsaccelerator:
NatvåCO3 + 4 C + Ntvå → 2 NaCN + 3 CO ↑
Applikationer
Vid utvinning av guld- och silvermineraler. Konsekvenser
Natriumcyanid har länge använts för att extrahera metallerna guld och silver från malmen..
Cyaniden som används i processen återvinns, men något flyr in i avfallsdammen tillsammans med de oåtervunna tungmetallerna.
Fåglar, fladdermöss och andra djur som dricker från dessa cyanidlaguner har förgiftats.
Det finns register över en damm i Rumänien som isolerade en avfallsdamm och skadades av en väderhändelse..
Som en följd släpptes massor av cyanid i Sasar-floden och närliggande vattenlevande system som floderna Lapus, Somes och Tisza och slutade i Donau..
Detta orsakade en kaskad av djurdödsfall, eller med andra ord, en ekologisk katastrof..

Vid produktion av andra kemiska föreningar
NaCN-natriumcyanid används vid syntes av olika typer av organiska föreningar.
Till exempel framställs pigment och färgämnen (inklusive optiska vitmedel), föreningar för användning inom jordbruk eller jordbrukskemikalier och olika läkemedel..
Det används också för att erhålla kelaterande eller bindande medel för metalljoner..
Föreningar som kallas nitriler framställs med natriumcyanid NaCN, som när de behandlas med varm sur eller alkalisk vattenlösning möjliggör erhållande av karboxylsyror.
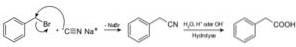
Det gör det möjligt att bereda fettsyror med cyanogrupper, tungmetallcyanider och hydrocyansyra eller HCN vätecyanid.
Inom metallindustrin
NaCN används i lösningar som används vid galvanisering eller galvanisering av metaller (beläggning av metaller med andra), till exempel zink.
Det är en komponent av härdat stål. Serverar även metallrengöring.
I andra användningsområden
Natriumcyanid är en mellanprodukt vid tillverkning av nylon.
Fungerar för separering av mineraler genom skumflotation.
Applikationer som är ur bruk, ifrågasatta eller mycket sällsynta
NaCN användes för att döda gnagare, såsom kaniner och råttor, och deras hålor och för att döda termitbon.
För närvarande används det ibland för att eliminera prärievargar, rävar och vilda hundar. Används i kapselform som enstaka eller flera doser på landområden, jaktmarker och skogar.
På grund av dess extrema toxicitet bör NaCN endast användas av utbildade individer..
Denna användning anses vara mycket farlig för människor, men det finns de som fortfarande använder den.

I jordbruket användes det tidigare för att gasa citrusfruktträd och andra frukter. Det användes också som ett insektsmedel och miticid (kvalstereliminator) som applicerades efter skörd, för icke lagrade citrusfrukter eller för gasning av lastbilar som används för att transportera dem. Det användes också för att gasa fartyg, järnvägsvagnar och lager..
Alla dessa användningar har ifrågasatts på grund av natriumcyanidens höga toxicitet. Av denna anledning används den inte längre eller bara mycket sällan och under mycket kontrollerade förhållanden..
Referenser
- USA National Library of Medicine. (2019). Natriumcyanid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Hurst, H.E. och Martin, M.D. (2017). Toxikologi. Cyanid. In Pharmacology and Therapeutics for Dentistry (Sjunde upplagan). Återställd från sciencedirect.com.
- Coppock, R.W. och Dziwenka, M. (2015). Hot mot djurlivet av agenter för kemisk krigföring. I Handbook of Toxicology of Chemical Warfare Agents (andra upplagan). Återställd från sciencedirect.com.
- Morrison, R.T. och Boyd, R.N. (2002). Organisk kemi. 6: e upplagan. Prentice-Hall.



Ingen har kommenterat den här artikeln än.