
Cykloalkanegenskaper, reaktioner, användningar, exempel

De cykloalkaner är en familj av mättade kolväten med en allmän formel av CnH2n som sammanfaller med alkenernas; med skillnaden att den uppenbara omättningen inte beror på en dubbelbindning utan på en ring eller cykel. Det är därför de anses vara isomerer av alkener.
Dessa bildas när linjära alkaner sammanfogar ändarna av sina kedjor för att skapa en sluten struktur. Som med alkaner kan cykloalkaner uppvisa olika storlekar, molekylmassor, substitutioner eller till och med system som består av mer än en ring (polycyklisk).
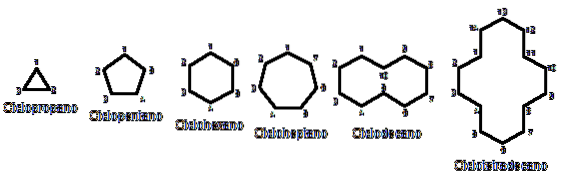
Annars liknar de kemiskt och fysiskt alkaner. De har endast kol och väten, är neutrala molekyler och interagerar därför genom Van der Walls-krafter. De fungerar också som bränslen och släpper ut värme när de brinner i närvaro av syre..
Varför är cykloalkaner mer instabila än deras motsvarigheter med öppen kedja? Anledningen kan misstänkas genom att från fågelperspektiv observera exemplen på cykloalkaner som representeras i bilden ovan: det finns steriska (rumsliga) spänningar och hinder.
Observera att ju färre kol det finns (listade i blått), desto mer stängd är strukturen; och motsatsen inträffar när de ökar och blir som ett halsband.
Små cykloalkaner är gasformiga, och när deras storlek ökar ökar deras intermolekylära krafter. Följaktligen kan de vara vätskor som kan lösa upp fetter och apolära molekyler, smörjmedel eller fasta ämnen som uppvisar mörka färger och egenskaper som de som asfalt..
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 1.1 Polaritet
- 1.2 Intermolekylära interaktioner
- 1.3 Mättnad
- 1.4 Stabilitet
- 2 Nomenklatur
- 3 Struktur
- 3.1 Konstruktioner
- 4 Reaktioner
- 5 användningsområden
- 6 Exempel på cykloalkaner
- 7 Referenser
Fysiska och kemiska egenskaper
Polaritet
Genom att endast bestå av kol och väten, atomer som i sig inte skiljer sig för mycket i elektronegativitet, gör detta att cykloalkanmolekylerna är apolära och därför saknar dipolmoment.
De kan inte interagera genom dipol-dipolkrafter, men beror specifikt på Londons krafter, som är svaga men ökar med molekylär massa. Det är därför små cykloalkaner (med mindre än fem kol) är gasformiga..
Intermolekylära interaktioner
Å andra sidan, eftersom de är ringar, har cykloalkaner en större kontaktyta, vilket gynnar Londonkrafterna mellan deras molekyler. Således grupperar och interagerar de på ett bättre sätt jämfört med alkaner; och därför är dess kok- och smältpunkter högre.
Eftersom de har två färre väteatomer (CnH2n för cykloalkaner och CnH2n + 2 för alkaner), de är lättare; och lägger till detta faktum med dess större kontaktyta, volymen upptagen av dess molekyler minskar, och därför är de tätare.
Mättnad
Varför klassificeras cykloalkaner som mättade kolväten? Eftersom de inte har ett sätt att införliva en vätemolekyl; såvida inte ringen öppnas, i vilket fall de skulle bli enkla alkaner. För att ett kolväte ska betraktas som mättat måste det ha maximalt antal C-H-bindningar.
Stabilitet
Kemiskt liknar de mycket alkaner. Båda har C-C och C-H-bindningar, som inte är så lätta att bryta för att producera andra produkter. Emellertid skiljer sig deras relativa stabiliteter, vilket kan verifieras experimentellt genom att mäta deras förbränningsvärme (Ahhårkam).
Till exempel när man jämför AHhårkam för propan och cyklopropan (representerad av en triangel i bilden) har vi 527,4 kcal / mol respektive 498,9 kcal / mol.
Detaljen är att cyklopropanen, baserad på förbränningsvärmen för alkanerna, ska ha en ΔHhårkam lägre (471 kcal / mol) eftersom de är tre metylengrupper, CHtvå; men i verkligheten släpper den ut mer värme, vilket återspeglar större instabilitet än uppskattat. Detta överskott av energi sägs då bero på spänningarna i ringen..
Och i själva verket styr dessa spänningar och differentierar reaktiviteten eller stabiliteten hos cykloalkaner, med avseende på alkaner, mot specifika reaktioner. Så länge spänningarna inte är särskilt höga tenderar cykloalkaner att vara mer stabila än deras respektive alkaner..
Nomenklatur
IUPAC-nomenklaturen för cykloalkaner skiljer sig inte mycket från den för alkaner. Den enklaste regeln av alla är att placera prefixet cyklo- till namnet på alkanen från vilken cykloalkanen bildas.
Således exempelvis från n-hexan, CH3CHtvåCHtvåCHtvåCHtvåCH3, du får cyklohexan (representerad av en sexkant i den första bilden). Detsamma händer med cyklopropan, cyklobutan etc..
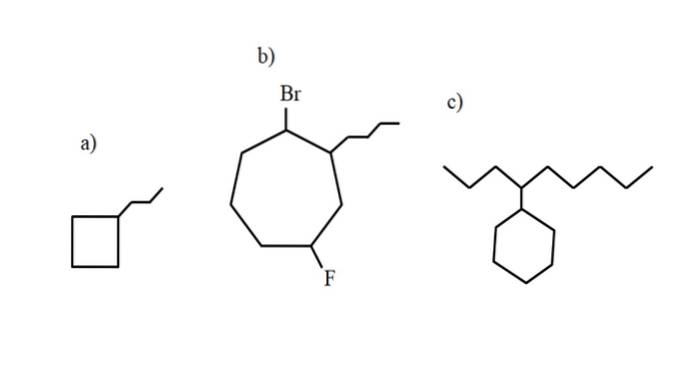
Dessa föreningar kan emellertid genomgå substitutioner av en av deras väten. När antalet kolatomer i ringen är större än för alkylsubstituenterna tas ringen som huvudkedjan; detta är fallet med a) för bilden ovan.
Observera att i a) cyklobutanen (fyrkanten) har fler kol än propylgruppen fäst vid den; sedan benämns denna förening som propylcyklobutan.
Om det finns mer än en substituent bör de namnges i alfabetisk ordning och på ett sådant sätt att de har lägsta möjliga lokaliseringsnummer. Exempelvis kallas b): 1-bromo-4-fluoro-2-butylcycloheptane (och inte 1-bromo-5-fluoro-7-butylcycloheptane, vilket skulle vara felaktigt).
Och slutligen, när alkylsubstituenten har fler kol än ringen, sägs den senare vara substituentgruppen i huvudkedjan. Således kallas c): 4-cyklohexylnonan.
Strukturera
Bortsett från de substituerade cykloalkanerna är det bekvämt att bara fokusera på deras strukturella baser: ringarna. Dessa avbildades i den första bilden.
Att observera dem kan leda till en falsk uppfattning att sådana molekyler är platta; men med undantag av cyklopropan är dess ytor "sicksackande", med kol som stiger eller faller i förhållande till samma plan.
Detta beror på att alla kol är hybridiserade till att börja med.3, och presenterar därför tetraedriska geometrier med bindningsvinklar på 109,5 °. Men om ringenas geometri noggrant observeras är det omöjligt att deras vinklar är dessa; till exempel är vinklarna inom cyklopropantriangeln 60º.
Detta är vad som kallas vinkelspänning. Ju större ringarna är, är vinkeln mellan C-C-bindningarna närmare 109,5 °, vilket orsakar en minskning av nämnda spänning och en ökad stabilitet för cykloalkanen..
Ett annat exempel observeras i cyklobutan, vars bindningsvinklar är 90º. Redan i cyklopentan är dess vinklar 108º, och från cyklohexan sägs det då att vinkelspänningen slutar utöva en så anmärkningsvärd destabiliserande effekt.
Konformationer
Förutom vinkelspänning finns det andra faktorer som bidrar till den stress som cykloalkaner upplever..
C-C-bindningarna kan inte bara rotera, eftersom detta skulle innebära att hela strukturen skulle "skaka". Således kan dessa molekyler anta väldefinierade rumsliga konformationer. Syftet med dessa rörelser är att minska spänningarna orsakade av väteatomernas förmörkelse; det vill säga när de är framför varandra.
Till exempel liknar konformationerna för cyklobutan en fjäril som slår sina vingar; de av cyklopentan, ett hölje; de av cyklohexan, en båt eller stol, och ju större ringen desto större antal och former kan de ta i rymden.
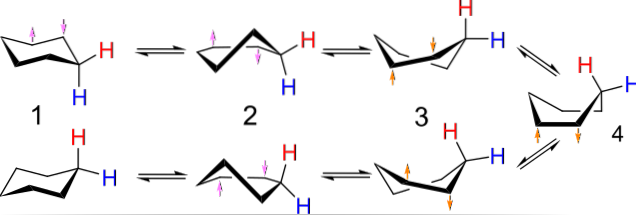
Bilden ovan visar ett exempel på sådana konformationer för cyklohexan. Observera att den förmodade platta hexagonen faktiskt ser mer ut som en stol (till vänster om bilden) eller en båt (till höger). Ett väte representeras av en röd bokstav och en annan med en blå bokstav för att ange hur deras relativa positioner förändras efter inversionerna..
I (1), när väte är vinkelrätt mot ringens plan, sägs det vara i axiellt läge; och när det är parallellt med detta sägs det vara i ekvatorialläget.
Reaktioner
Reaktionerna som cykloalkaner kan genomgå är desamma som för alkaner. Båda brinner i närvaro av överskott av syre vid typiska förbränningsreaktioner för att producera koldioxid och vatten. Likaså kan båda genomgå halogeneringar, i vilka ett väte ersätts med en halogenatom (F, Cl, Br, I).
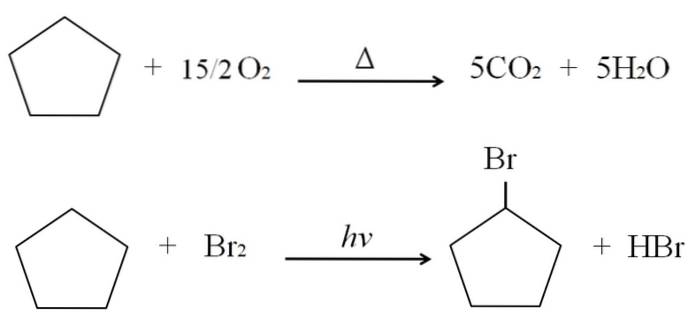
Förbrännings- och halogeneringsreaktionerna för cyklopentan visas som exempel ovan. En mol av den brinner i närvaro av värme och 7,5 mol molekylärt syre för att sönderdelas till COtvå och HtvåO. Å andra sidan, i närvaro av ultraviolett strålning och brom, ersätter den en H för en Br, vilket frigör en gasformig molekyl av HBr.
Applikationer
Användningen av cykloalkaner är starkt beroende av deras kolantal. De lättaste, och därför gasformiga, användes en gång för att driva gaslamporna i allmän belysning.
Vätskor har å sin sida verktyg som lösningsmedel för oljor, fetter eller kommersiella produkter av icke-polär karaktär. Bland dessa kan nämnas cyklopentan, cyklohexan och cykloheptan. På samma sätt tenderar de att användas mycket ofta vid rutinmässiga operationer i petroleumlaboratorier eller vid beredning av bränslen..
Om de är tyngre kan de användas som smörjmedel. Å andra sidan kan de också representera utgångsmaterialet för syntes av läkemedel; såsom karboplatin, som inkluderar en cyklobutanring i sin struktur.
Exempel på cykloalkaner
Slutligen återgår vi till början av artikeln: bilden med flera osubstituerade cykloalkaner.
För att memorera cykloalkaner, tänk bara på de geometriska figurerna: triangel (cyklopropan), kvadrat (cyklobutan), pentagon (cyklopentan), hexagon (cyklohexan), heptagon (cykloheptan), decagon (cyklodekan), pentadekagon (cyklopentadekan) och så vidare..
Ju större ringen desto mindre liknar den respektive geometriska figur. Man har redan sett att cyklohexan är allt annat än en sexkant; detsamma är tydligare med cyklotetradekan (fjorton kol).
Det kommer en punkt där de kommer att bete sig som halsband som kan vikas för att minska spänningarna i deras länkar och förmörkelser så mycket som möjligt..
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Kemi LibreTexts. (02 juni 2019). Namngivning av cykloalkaner. Återställd från: chem.libretexts.org
- Wikipedia. (2019). Cykloalkan. Återställd från: en.wikipedia.org
- Clark Jim. (2015). Introduktion av alkaner och cykloalkaner. Återställd från: chemguide.co.uk
- James Ashenhurst. (2019). Konstruktioner och cykloalkaner. Master organisk kemi. Återställd från: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cykloalkaner-teori. Organisk kemi. Återställd från: quimicaorganica.org

Ingen har kommenterat den här artikeln än.