
Arsenious acid (H3AsO3) egenskaper, risker och användningar
De arsenisk syra det är en oorganisk förening med formeln H3AsO3. Dess struktur är analog med trihydroxiamin och kan skrivas om som As (OH) 3. Det är i vattenform och det har inte varit möjligt att isolera det i rent fast tillstånd. Dess struktur presenteras i figur 1.
Utarbetningen av As (OH) 3 medför en långsam hydrolys av arseniktrioxid i vatten. Basens summa omvandlar arsenös syra till arsenitjoner: [AsO (OH) 2] -, [AsO2 (OH)] 2- och [AsO3] 3-.
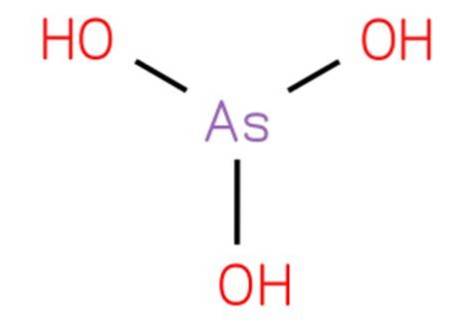
Det är en svag syra. Reaktioner som tillskrivs vattenhaltig arseniktrioxid beror på arseniksyra och dess konjugatbaser.
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos arsenös syra
- 2 Reaktivitet och faror
- 2.1 Vid kontakt med ögonen
- 2.2 Vid hudkontakt
- 2.3 Vid förtäring
- 2.4 Vid inandning
- 3 användningsområden
- 4 Referenser
Fysikaliska och kemiska egenskaper hos arsenös syra
Arsenös syra är en pyramidmolekyl som består av tre hydroxylgrupper bundna till arsenik. 1H NMR-spektrumet av arseninsyralösningar består av en enda signal som överensstämmer med molekylens höga symmetri. Finns endast i vattenlösning.
Nämnda lösning är färglös och har ingen karakteristisk arom. Den lagras i bärnstensfärgade behållare för att undvika reaktion med UV-strålning (National Center for Biotechnology Information, 2017).

Dess molekylvikt är 125,94 g / mol. Även om föreningen inte har isolerats har dess egenskaper beräknats med hjälp av beräkningsmetoder (© Royal Society of Chemistry, 2015) för att få en smältpunkt på 271,52 ° C, en kokpunkt på 626,14 ° C och en vattenlöslighet på 1 x 106 mg / l vid 25 ° C.
Föreningen har en pKa av 9,2 för reaktionen:
H3AsO3 ⇌ H2AsO3- + H+
Litteraturen rapporterar att föreningen har en amfoter karaktär, även om den dissocieras som en bas i mindre grad än den dissocieras som en syra, med basen som har en pKb på 14 för reaktionen:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Detta leder till bildning av arter såsom sura arsenikhydroxidsulfater (As (OH) (HSO4) +, As (OH) 2 (HSO4)) i koncentrerade lösningar av svavelsyra eller till bildandet av arseninsyrasulfat (As (HSO4). ) 3) i rökande svavelsyralösningar.
Arseniksyra kan fungera som ett oxidationsmedel eller ett reduktionsmedel och förbli som elementär arsenik respektive arseniksyra enligt halvreaktionerna:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0.240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Arsenisk syra är ett starkare oxidationsmedel än dess fosfoniska motsvarighet, men ett svagare reduktionsmedel än det (Egon Wiberg, 2001).
Reaktivitet och faror
Arsenös syra är en förening som klassificeras som stabil, men det är ett giftigt och frätande reagens.
Föreningen har en försumbar brand- och explosionsrisk när den utsätts för värme eller eld. I detta fall bör behållaren flyttas om möjligt, undvik att inandas ångor eller damm..
Vid uppvärmning släpper föreningen ut giftiga och frätande arsenikoxider. Fristående andningsapparat och skyddskläder bör användas för att undvika kontakt vid brand.
Det kan vara irriterande för ögon, hud och slemhinnor. Kan ge allergi. Förgiftning kan påverka centrala nervsystemet, mag-tarmkanalen och hjärt-kärlsystemet, levern och njurarna. Föreningar som innehåller arsenik är mycket giftiga och cancerframkallande.
Vid kontakt med ögonen
Tvätta med mycket vatten i minst 15 minuter och lyft ögonlocken ibland tills det inte finns några tecken på kemiska rester.
Vid hudkontakt
Tvätta genast med mycket tvål och vatten i minst 15 minuter medan du tar bort förorenade kläder och skor. Brännskador är täckta med ett torrt sterilt bandage (säkert, inte tätt).
Vid förtäring
Stora mängder vatten bör ges till det medvetna offret för att späda ut syran. Använd inte magsköljning eller framkalla kräkningar. Medicinsk personal måste hålla luftvägar och andning.
Vid inandning
Artificiell andning bör ges vid behov. Flytta offret till en sval plats och håll dig varm och i vila.
I alla fall bör omedelbar läkarvård sökas (säkerhetsdatablad Arsenious acid solution, 2007).
Applikationer
Arsenisk syra används för att detektera små mängder jod eller jodföreningar. I arbetet med (Weegh, 1972) studerades några aspekter av ceric reaktion av arseninsyra, med uppmärksamhet åt de optiska egenskaperna hos ceric lösningar..
De kinetiska effekterna av olika föreningar studerades, särskilt effekterna av klorid- och bromidjoner och de kinetiska effekterna av klorid eller bromid i kombination med jodid..
Arseniksyra kan också användas olagligt för att orsaka aborter (Trend, 1858).
Arsenös syra reagerar vid upphettning för att bilda arseniktrioxid (As2O3). Denna förening är också allmänt känd under namnet arsenosyra trots att den inte är samma förening. Strukturen för arseniktrioxid presenteras i figur 3.
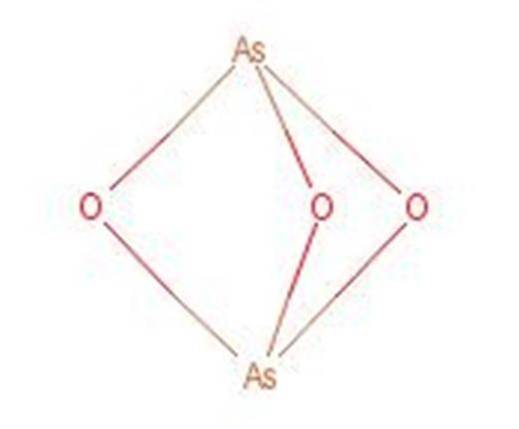
Figur 1: Struktur av arseniktrioxid.
Denna förening, även känd som Trisenox, används för att behandla leukemipatienter som inte har svarat på andra medel. Detta läkemedel är godkänt för användning av US Food and Drug Administration (FDA) som en behandling för leukemi..
Hur föreningen fungerar är oklart. Det kan orsaka morfologiska förändringar och DNA-fragmentering i promyelocytiska leukemiceller, orsaka celldöd och nedbrytning eller skada av PML / RAR alfa (ett fusionsprotein) (Nurse's Drug Handbook 7th Ed, 2013).
Eftersom det är giftigt för människokroppen är det ett av de mycket diskutabla läkemedlen i fältet. Arseniktrioxid användes först som en traditionell kinesisk medicin som heter Pi Shuang. Det används fortfarande idag för att behandla cancerpatienter och andra hälsotillstånd. (Arsenious acid review, 2007-2016).
Referenser
- © Royal Society of Chemistry. (2015). Arsenös syra. Återställd från chemspider.
- © Royal Society of Chemistry. (2015). Trihydroxiamin. Återställd från chemspider.
- Arsenisk syra recension. (2007-2016). Återställd från medicinsk kock.
- Arsenös syra. (2014, 28 juli). Återställd från ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Oorganisk kemi. Berlin: akademisk press.
- Säkerhetsdatablad Arsenisk syralösning. (2007, 10 september). Återställd från t3db.ca.
- Nationellt centrum för bioteknikinformation. (2017, 4 mars). PubChem Compound Database; CID = 545,. Hämtad från PubChem.
- Nurse's Drug Handbook 7th Ed. (2013). McGraw-Hill.
- Trend, H. G. (1858). Ett fall där allvarlig syra användes för att skaffa abort. brittiska medicinska journal originalkommunikationer, 725-726.
- Weegh, W. H. (1972). Användningen av ceriumsyrareasreaktionen för bestämning av små mängder jod eller jodföreningar. Clinica Chimica Acta Volym 39, nummer 2, 327-338.

Ingen har kommenterat den här artikeln än.