
Klorsyras (HClO2) formel, egenskaper och användningsområden

De klorsyra är en oorganisk förening med formeln HClOtvå. Nämnda syra är en av oxansyrorna i klor där den befinner sig i oxidationstillstånd 3+. Även om syran är svår att få i sin rena substans, är konjugatbasen härledd från dessa syror, kloritjonen, stabil..
Ett exempel på ett salt av denna anjon är den välkända natriumkloriten. Detta och relaterade salter används ibland vid framställning av klordioxid..
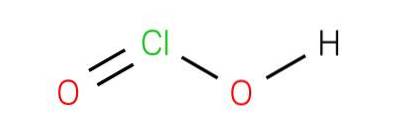
Klorsyra är en svag syra. Den rena substansen är instabil, oproportionerlig till hypoklorsyra (Cl + 1 oxidationstillstånd) och klorsyra (Cl +5 oxidationstillstånd):
2HClOtvå → HClO + HClO3
Klorsyra erhålls tillsammans med klorsyra vid sönderdelningen av den vattenhaltiga lösningen av klordioxid.
Klorsyralösningen erhölls för första gången genom att reducera klorsyra med vinsyra (A. J. Downs, 1973). Huvudmetoden för att erhålla denna syra är emellertid genom att behandla en suspension av bariumklorid med svavelsyra:
Ba (ClOtvå)två + HtvåSW4 → BaSO4 + 2HClOtvå
Klorsyra är ett kraftfullt oxidationsmedel, även om dess tendens till dismutation eller oproportion motverkar dess oxidationspotential..
Klor är den enda halogen som bildar en isolerbar syra med formeln HXOtvå. Varken bromsyra eller jodsyra har isolerats. Vissa salter av bromsyra, bromiter, är kända, men förutom som mellanprodukter i reaktioner finns det inga jodtsalter..
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 3 användningsområden
- 4 Referenser
Fysiska och kemiska egenskaper
Klorsyra, när den är isolerad, är en färglös vätska utan en karakteristisk arom (National Center for Biotechnology Information, 2017).
Föreningen har en molekylvikt av 68,456 g / mol. Den har en kokpunkt (beräknad) på 502,07 ° C och en löslighet i vatten (beräknad) på 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOtvå det är instabilt på grund av dismutations- (eller disproportionerings-) reaktionen för att producera klor- och hypoklorsyra (C. C. Hong, 1968) liknande den för de analoga bromsyrorna och jodsyrorna:
2HClOtvå → HClO + HClO3
Klorsyra anses vara en svag syra även om dess dissociationskonstant är i storleksordningen 1 x 10-två vilket inte gör det lika svagt som andra syror med en pKa på 1,96.
Reaktivitet och faror
Klorsyra är en instabil förening och ett starkt oxidationsmedel som är oförenligt med reduktionsmedel och alkalier..
Klorsyra irriterar vid hud- och ögonkontakt och är farligt vid förtäring och inandning.
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter och håll ögonlocken öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål..
Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Om hudkontakten är svår bör den tvättas med ett desinfektionsmedel och tvätta den förorenade huden med en antibakteriell kräm..
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt. Lossa trånga kläder som en skjortkrage, bälte eller slips.
Om offret har svårt att andas bör syre ges. Om offret inte andas utförs återupplivning från mun till mun. Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
Framkalla inte kräkning vid förtäring. Lossa trånga kläder som skjortkrage, bälten eller slipsar. Om offret inte andas, utför återupplivning från mun till mun. Sök alltid läkare omedelbart..
Applikationer
Studier har utförts där metastabila klorsyra / kloroxidlösningar används som munvatten för plackreduktion (Goultschin J, 1989).
Studien gjordes på en grupp av 18 volontärer i åldern 20-27 år. Dess effekt på plackutveckling och spottande bakterieantal testades, vilket gav en reduktion på upp till 34,5% minskning av tandplackpoäng jämfört med en placebogrupp.
Klorsyra är involverad i beredningen av natriumsyraklorit som har antimikrobiella egenskaper och är avsedd att användas främst som en spray- eller dopplösning för fjäderfä, kött, grönsaker, frukt och skaldjur. Används även i fjäderfäkylvatten.
Natriumsyraklorit framställs genom tillsats av en syra av livsmedelskvalitet (till exempel citronsyra, fosforsyra, saltsyra, äppelsyra eller natriumvätesulfat) till en vattenlösning av natriumklorit (NaClO).två).
Kombinationen av syran med natriumkloritlösningen resulterar i omvandling av klorit till metastabil klorsyra (HClO).två).
NaClOtvå + H+ ⇌ HClOtvå + Na+
Denna lösning kan senare bilda en blandning med klorit (ClOtvå-klordioxid (ClOtvåoch klorid (Cl). Reaktionen genererar en oxidativ lösning med oxiklorerade arter med antimikrobiella egenskaper.
Sodium Acid Chlorite är utformad för att användas som en del av ett integrerat tillvägagångssätt utformat för att kontrollera mikrobiella belastningar i livsmedel.
Natriumsyrakloritlösning verkar för att minska antalet patogener (till exempel Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp. Och Listeria monocytogenes) (Rao, 2006).
Referenser
- J. Downs, C. J. (1973). Kemin av klor, brom, jod och astatin: Pergamon ..., volym 7. New York: Pergamonpress.
- C. Hong, W. H. (1968). Kinetik för oproportionering av klorsyra. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28 juli). klorsyra. Återställd från ChEBI: ebi.ac.uk.
- Goultschin J, G. J. (1989). Användning av en metastabiliserad klorsyra / klordioxidformulering som munvatten för minskning av plack. Isr J Dent Sci.2 (3), 142-147. ncbi.nlm.nih.gov.
- Nationellt centrum för bioteknikinformation ... (2017, 30 april). PubChem Compound Database CID = 24453. Hämtad från PubChem.
- Rao, M. V. (2006, december). SURAD NATRIUMKLORIT (ASC) Kemisk och teknisk bedömning. Återställd från fao.org.
- Royal Society of Chemistry. (2015). Klorsyra. Återställd från chemspider.com.



Ingen har kommenterat den här artikeln än.