
Jodsyra (HIO2) egenskaper och användningsområden

De jodsyra Det är en kemisk förening med formeln HIO2. Denna syra, liksom dess salter (känd som joditer), är extremt instabila föreningar som har observerats men aldrig isolerats.
Det är en svag syra, vilket innebär att den inte dissocierar helt. I anjonen är jod i oxidationstillstånd III och har en struktur analog med klorsyra eller bromsyra, såsom illustreras i figur 1.
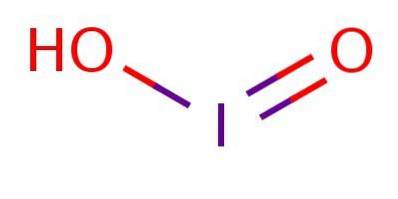
Trots att föreningen är instabil har jodsyra och dess jodtsalter detekterats som mellanprodukter vid omvandlingen mellan jodider (I-) och jodater (IO3-).
Dess instabilitet beror på en dismutationsreaktion (eller disproportion) för att bilda hypojodidsyra och jodsyra, som är analog med klor- och bromsyror på följande sätt:
2HIO2 -> HIO + HIO3
I Neapel 1823 skrev forskaren Luigi Sementini ett brev till E. Daniell, sekreterare för den kungliga institutionen i London, där han förklarade en metod för att erhålla jodsyra.
I brevet sa han att med tanke på att bildandet av salpetersyra var att kombinera salpetersyra med det han kallade salpetersyra (eventuellt NtvåO), jodsyra kunde bildas på samma sätt genom att reagera jodsyra med jodoxid, en förening som han hade upptäckt.
Genom att göra detta fick han en gul-bärnstensfärgad vätska som tappade sin färg vid kontakt med atmosfären (Sir David Brewster, 1902).
Senare upptäckte forskaren M. Wöhler att Sementinis syra är en blandning av jodklorid och molekylär jod, eftersom jodoxiden som användes i reaktionen bereddes med kaliumklorat (Brande, 1828).
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 användningsområden
- 2.1 Nukleofil acylering
- 2.2 Demutationsreaktioner
- 2.3 Bray-Liebhafsky-reaktioner
- 3 Referenser
Fysiska och kemiska egenskaper
Som nämnts ovan är jodsyra en instabil förening som inte har isolerats, så dess fysiska och kemiska egenskaper erhålls teoretiskt genom beräkningsberäkningar och simuleringar (Royal Society of Chemistry, 2015).
Jodsyra har en molekylvikt på 175,91 g / mol, en densitet på 4,62 g / ml i fast tillstånd, en smältpunkt på 110 grader Celsius (jodsyra, 2013-2016).
Den har också en löslighet i vatten på 269 g / 100 ml vid 20 grader Celsius (som är en svag syra), har en pKa på 0,75 och har en magnetisk känslighet på −48,0 · 10−6 cm3 / mol (National Center for Biotechnology Information, sf).
Eftersom jodsyra är en instabil förening som inte har isolerats finns det ingen risk att hantera den. Det har visat sig vid teoretiska beräkningar att jodsyra inte är brandfarligt..
Applikationer
Nukleofil acylering
Jodsyra används som en nukleofil i nukleofila acyleringsreaktioner. Exemplet ges med acylering av trifluoracetyler såsom 2,2,2-trifluoracetylbromid, 2,2,2-trifluoracetylklorid, 2,2,2-trifluoracetylfluorid och 2,2,2-trifluoracetyljodid för att bilda jodosyl 2,2,2 trifluoracetat såsom illustreras i figur 2.1, 2.2, 2.3 respektive 2.4.

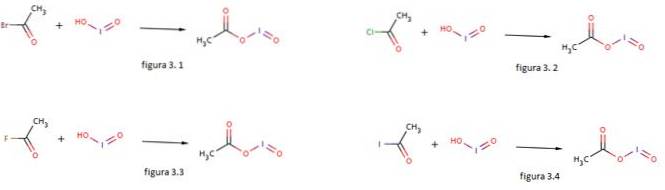
Jodsyra används också som en nukleofil för bildandet av jodosylacetat genom att reagera den med acetylbromid, acetylklorid, acetylfluorid och acetyljodid som visas i figurerna 3.1, 3.2, 3.3 respektive 3.4 (GNU Free Documentation, sf).
Dismutationsreaktioner
Disutrations- eller oproportioneringsreaktioner är en typ av oxidminskningsreaktion, där ämnet som oxideras är detsamma som reduceras.
När det gäller halogener, eftersom de har oxidationstillstånd på -1, 1, 3, 5 och 7, kan olika produkter av dismutationsreaktioner erhållas beroende på de använda betingelserna..
När det gäller jodsyra, exempel på hur den reagerar för att bilda hypojodsyra och jodsyra av formen.
2HIO2 -> HIO + HIO3
Nyligen genomförda studier har analyserat jodsyrans dismutationsreaktion genom att mäta koncentrationerna av protoner (H+), jodat (IO3-och den sura hypojoditkatjonen (HtvåIO+) för att bättre förstå mekanismen för jodsyrademutation (Smiljana Marković, 2015).
En lösning framställdes innehållande den mellanliggande arten I3+. En blandning av jod (I) och jod (III) framställdes genom upplösning av jod (Itvå) och kaliumjodat (KIO3i förhållandet 1: 5, i koncentrerad svavelsyra (96%). I denna lösning fortsätter en komplex reaktion, som kan beskrivas genom reaktionen:
Jagtvå + 3IO3- + 8H+ -> 5IO+ + HtvåELLER
Art I3+ de är stabila endast i närvaro av överskott av jodat. Jod förhindrar bildandet av I3+. IO-jonen+ Erhålls i form av jodsulfat (IO) tvåSW4sönderdelas snabbt i sur vattenlösning och form I3+, representerad som sur HIOtvå eller den joniska arten IO3-. Därefter genomfördes en spektroskopisk analys för att bestämma värdet av koncentrationerna av jonerna av intresse..
Detta presenterade ett förfarande för utvärdering av pseudo-jämviktskoncentrationer av väte, jodat och H-joner.tvåJAG HÖRDE+, Kinetiska och katalytiska arter viktiga i processen för oproportionering av jodsyra, HIOtvå.
Bray-Liebhafsky-reaktioner
En kemisk klocka eller svängningsreaktion är en komplex blandning av reagerande kemiska föreningar, där koncentrationen av en eller flera komponenter förändras periodiskt, eller när plötsliga förändringar i egenskaper inträffar efter en förutsägbar induktionstid.
De är en klass av reaktioner som fungerar som ett exempel på icke-jämviktstermodynamik, vilket resulterar i upprättandet av en icke-linjär oscillator. De är teoretiskt viktiga eftersom de visar att kemiska reaktioner inte behöver domineras av jämviktstermodynamiskt beteende..
Bray-Liebhafsky-reaktionen är en kemisk klocka som först beskrevs av William C. Bray 1921 och är den första svängningsreaktionen i en omrörd homogen lösning..
Jodsyra används experimentellt för att studera denna typ av reaktion när den oxideras med väteperoxid, vilket ger en bättre överensstämmelse mellan den teoretiska modellen och experimentella observationer (Ljiljana Kolar-Anić, 1992).
Referenser
- Brande, W. T. (1828). En kemikaliehandbok baserad på professor Brande. Boston: University of Harvard.
- GNU gratis dokumentation. (s.f.). jodsyra. Hämtad från chemsink.com: chemsink.com
- jodsyra. (2013-2016). Hämtad från molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mekanism för Bray-Liebhafsky-reaktionen: effekt av oxidation av jodsyra av väteperoxid. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Nationellt centrum för bioteknikinformation. (n.d.). PubChem Compound Database; CID = 166623. Hämtad från pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Jodsyra ChemSpider ID145806. Hämtad från ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). London och Edinburgh Philosophical Magazine och Journal of Science. london: University of London.
- Smiljana Marković, R. K. (2015). Disproportioneringsreaktion av jodsyra, HOIO. Bestämning av koncentrationerna av relevanta jonarter H +, H2OI + och IO3 -.



Ingen har kommenterat den här artikeln än.