
Kemiskt koncentrationsuttryck, enheter, molalitet

De kemisk koncentration är det numeriska måttet på den relativa mängden löst ämne i en lösning. Detta mått uttrycker ett förhållande mellan löst ämne och en mängd eller volym av lösningsmedlet eller lösningen i koncentrationsenheter. Uttrycket "koncentration" är relaterat till mängden närvarande löst ämne: en lösning kommer att vara mer koncentrerad ju mer löst den har.
Dessa enheter kan vara fysiska när massans och / eller volymstorlekarna för lösningen eller kemiska komponenter beaktas, när koncentrationen av det lösta ämnet uttrycks i termer av dess mol eller ekvivalenter, med Avogadros nummer som referens..

Genom att använda molekyl- eller atomvikter och Avogadros antal är det således möjligt att konvertera fysiska enheter till kemiska enheter när man uttrycker koncentrationen av en given lösning. Därför kan alla enheter konverteras till samma lösning.
Artikelindex
- 1 Utspädda och koncentrerade lösningar
- 2 sätt att uttrycka koncentration
- 2.1 Kvalitativ beskrivning
- 2.2 Klassificering efter löslighet
- 2.3 Kvantitativ notation
- 3 Koncentrationsenheter
- 3.1 Relativa koncentrationsenheter
- 3.2 Enheter med utspädd koncentration
- 3.3 Enheter av koncentration som funktion av mol
- 3.4 Formalitet och normalitet
- 4 Molaritet
- 4.1 Övning 1
- 4.2 Övning 2
- 5 Normalitet
- 5.1 Beräkning
- 5.2 Övning 1
- 6 Molalitet
- 6.1 Övning 1
- 7 Viktiga anmärkningar och rekommendationer om kemisk koncentration
- 7.1 Volymen av lösningen är alltid större än lösningsmedlets volym
- 7.2 Användning av molaritet
- 7.3 Formler lagras inte utan enheter eller definitioner
- 8 Referenser
Utspädda och koncentrerade lösningar
Hur kan du se om en koncentration är mycket utspädd eller koncentrerad? Vid första anblicken genom manifestationen av någon av dess organoleptiska eller kemiska egenskaper; det vill säga de som sinnena uppfattar eller som kan mätas.
Bilden ovan visar en utspädning av en koncentration av kaliumdikromat (KtvåCrtvåELLER7), som har en orange färg. Från vänster till höger kan du se hur färgen minskar sin intensitet när koncentrationen späds, vilket ger mer lösningsmedel.
Denna utspädning gör det möjligt att på detta sätt erhålla en utspädd koncentration från en koncentrerad koncentration. Färgen (och andra "dolda" egenskaper i dess orange kärna) förändras på samma sätt som koncentrationen gör, antingen med fysiska eller kemiska enheter..
Men vad är de kemiska koncentrationsenheterna? Bland dem är molariteten eller molkoncentrationen av en lösning, som relaterar mol upplöst med den totala volymen av lösningen i liter.
Det finns också molalitet eller kallas också molalkoncentration, vilket hänvisar till molen av löst ämne men som finns i en standardiserad mängd av lösningsmedlet eller lösningsmedlet som är exakt ett kilo.
Detta lösningsmedel kan vara rent eller om lösningen innehåller mer än ett lösningsmedel kommer molaliteten att vara mol löst ämne per kilo lösningsmedelsblandningen..
Och den tredje enheten av kemisk koncentration är normaliteten eller den normala koncentrationen av en lösning som uttrycker antalet kemiska ekvivalenter av löst ämne per liter lösningen.
Enheten i vilken normalitet uttrycks är i ekvivalenter per liter (Eq / L) och i medicin uttrycks koncentrationen av elektrolyter i humant serum i milliekvivalenter per liter (mEq / L).
Sätt att uttrycka koncentration på

Koncentrationen av en lösning kan betecknas på tre huvudsakliga sätt, även om de själva har en stor variation av termer och enheter, som kan användas för att uttrycka måttet på detta värde: kvalitativ beskrivning, kvantitativ notering och klassificering i termer av löslighet.
Beroende på språket och det sammanhang där du arbetar, väljs ett av de tre sätten att uttrycka koncentrationen av en blandning.
Kvalitativ beskrivning
Används främst på ett informellt och icke-tekniskt språk, den kvalitativa beskrivningen av koncentrationen av en blandning uttrycks i form av adjektiv, som på ett generaliserat sätt anger koncentrationsnivån som en lösning har.
På detta sätt är den lägsta koncentrationsnivån enligt den kvalitativa beskrivningen den för en "utspädd" lösning, och den högsta är den för "koncentrerad"..
Vi talar om utspädda lösningar när en lösning har en mycket låg andel löst som en funktion av den totala volymen av lösningen. Om du vill späda en lösning måste du tillsätta mer lösningsmedel eller hitta ett sätt att minska lösningen.
Nu talar vi om koncentrerade lösningar när de har en hög andel löst ämne som en funktion av den totala lösningsvolymen. För att koncentrera en lösning måste du tillsätta mer löst ämne eller minska mängden lösningsmedel.
I denna mening kallas denna klassificering en kvalitativ beskrivning, inte bara för att den saknar matematiska mätningar utan också på grund av dess empiriska kvalitet (den kan hänföras till visuella egenskaper, lukt och smak, utan behov av vetenskapliga tester)..
Klassificering efter löslighet
Lösligheten i en koncentration anger den maximala lösningskapaciteten som en lösning har, beroende på förhållanden som temperatur, tryck och ämnen som är upplösta eller i suspension..
Lösningar kan klassificeras i tre typer efter deras nivå av löst löst vid mätningstidpunkten: omättade, mättade och övermättade lösningar.
- Omättade lösningar är de som innehåller mindre löst ämne än lösningen kan lösas upp. I detta fall har lösningen inte nått sin maximala koncentration.
- Mättade lösningar är de i vilka den maximala mängden löst ämne har lösts upp i lösningsmedlet vid en specifik temperatur. I detta fall finns det en jämvikt mellan båda ämnena och lösningen kan inte acceptera mer löst ämne (eftersom det kommer att fällas ut).
- Övermättade lösningar har mer löst ämne än lösningen skulle acceptera under jämviktsförhållanden. Detta åstadkoms genom att värma en mättad lösning, tillsätta mer löst ämne än normalt. När det är kallt kommer det inte att fälla ut det lösta ämnet automatiskt, men störningar kan orsaka denna effekt på grund av dess instabilitet..
Kvantitativ notation
När man studerar en lösning som ska användas inom det tekniska eller vetenskapliga området krävs en precision som mäts och uttrycks i enheter, som beskriver koncentrationen enligt dess exakta värden på massa och / eller volym..
Det är därför det finns en serie enheter som används för att uttrycka koncentrationen av en lösning i dess kvantitativa notation, som är indelade i fysikaliska och kemiska, och som i sin tur har sina egna indelningar.
Enheterna för fysiska koncentrationer är de med "relativ koncentration", vilka uttrycks i procent. Det finns tre sätt att uttrycka procentkoncentrationer: massprocent, volymprocent och massvolymprocent..
Istället är enheter av kemiska koncentrationer baserade på molära mängder, gramekvivalenter, delar per miljon och andra egenskaper hos lösningen i förhållande till lösningen..
Dessa enheter är de vanligaste på grund av deras höga precision vid mätning av koncentrationer, och av den anledningen är de vanligtvis de som du vill veta för att arbeta med kemiska lösningar..
Koncentrationsenheter
Som beskrivs i föregående avsnitt måste beräkningarna styras av de befintliga enheterna för detta ändamål när man kvantitativt koncentrerar en lösning..
På samma sätt är koncentrationsenheterna uppdelade i de med relativ koncentration, de med utspädda koncentrationer, de baserade på mol och andra ytterligare..
Relativa koncentrationsenheter
Relativa koncentrationer är de som uttrycks i procent, som nämns i föregående avsnitt. Dessa enheter är uppdelade i mass-massprocent, volym-volymprocent och massvolymprocent och beräknas enligt följande:
- % massa = massa av löst ämne (g) / massa av total lösning (g) x 100
- % volym = volym löst (ml) / volym total lösning (ml) x 100
- % massa / volym = massa av löst ämne (g) / volym av total lösning (ml) x 100
I detta fall, för att beräkna massan eller volymen av den totala lösningen, måste massan eller volymen av den lösta produkten tillsättas med lösningsmedlets massa..
Enheter med utspädd koncentration
De utspädda koncentrationsenheterna är de som används för att uttrycka de mycket små koncentrationer som finns i form av spår i en utspädd lösning; den vanligaste användningen för dessa enheter är att hitta spår av en gas upplöst i en annan, såsom medel som förorenar luften.
Dessa enheter anges i form av delar per miljon (ppm), delar per miljard (ppb) och delar per biljon (ppt) och uttrycks på följande sätt:
- ppm = 1 mg löst / 1 L lösning
- ppb = 1 μg löst / 1 L lösning
- ppt = 1 ng löst / 1 liter lösning
I dessa uttryck är mg lika med milligram (0,001 g), μg är lika med mikrogram (0,000001 g) och ng är lika med nanogram (0,000000001 g). Dessa enheter kan också uttryckas som en funktion av volym / volym.
Koncentrationsenheter som en funktion av mol
Koncentrationsenheterna baserade på mol är de för molfraktionen, molprocenten, molariteten och molaliteten (de två senare beskrivs bättre i slutet av artikeln).
Molfraktionen av ett ämne är fraktionen av alla dess ingående molekyler (eller atomer) som en funktion av de totala molekylerna eller atomerna. Den beräknas enligt följande:
XTILL = antal mol ämne A / totalt antal mol i lösning
Denna procedur upprepas för de andra substanserna i lösning, med hänsyn till att summan av XTILL + XB + XC ... måste vara lika med en.
Molprocenten bearbetas på liknande sätt som XTILL, endast i procent:
Molprocent av A = XTILL x 100%
Det sista avsnittet kommer att diskutera molaritet och molalitet i detalj..
Formalitet och normalitet
Slutligen finns det två enheter av koncentration som för närvarande inte används: formalitet och normalitet..
Formaliteten hos en lösning representerar antalet vikt-formel-gram per liter total lösning. Det uttrycks som:
F = Nej. P.F.G / L-lösning
I detta uttryck är P.F.G lika med vikten av varje atom i ämnet, uttryckt i gram.
Istället representerar normaliteten antalet lösta ekvivalenter dividerat med liter lösning, som uttryckt nedan:
N = ekvivalent gram löst / L-lösning
I detta uttryck kan ekvivalenta gram löst ämne beräknas med antalet mol H+, Åh- eller andra metoder, beroende på typen av molekyl.
Molaritet
Molariteten eller molkoncentrationen hos ett löst ämne är den enhet av kemisk koncentration som uttrycker eller relaterar molen av det lösta ämnet (n) som finns i en (1) liter (L) av lösningen.
Molaritet betecknas med stora bokstäver M och för att bestämma molen av löst ämne (n) delas gram av löst ämne (g) med molekylvikten (MW) för det lösta ämnet..
På samma sätt erhålls molekylvikten MW för det lösta ämnet från summan av atomvikterna (PA) eller atommassan för de kemiska elementen, med beaktande av andelen i vilken de kombineras för att bilda det lösta ämnet. Således har olika lösta ämnen sin egen PM (även om detta inte alltid är fallet).
Dessa definitioner sammanfattas i följande formler som används för att utföra motsvarande beräkningar:
Molaritet: M = n (mol löst ämne) / V (liter lösning)
Antal mol: n = g löst ämne / MW löst ämne
Övning 1
Beräkna molariteten för en lösning som bereds med 45 g Ca (OH)två löstes i 250 ml vatten.
Det första man ska beräkna är molekylvikten av Ca (OH)två (kalcium hydroxid). Enligt dess kemiska formel består föreningen av en kalciumkatjon och två hydroxylanjoner. Här är vikten av en elektron som är mindre eller ytterligare till arten försumbar, så atomvikterna tas:
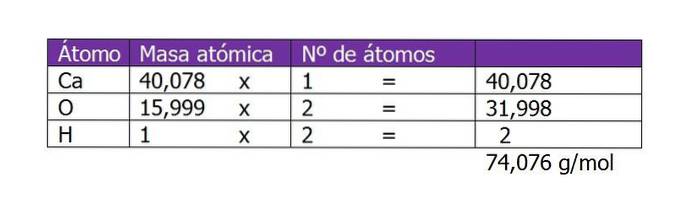
Antalet mol av det lösta ämnet blir då:
n = 45 g / (74 g / mol)
n = 0,61 mol Ca (OH)två
0,61 mol av det upplösta ämnet erhålls men det är viktigt att komma ihåg att dessa mol ligger upplösta i 250 ml lösning. Eftersom definitionen av molaritet är mol i a liter eller 1000 ml måste en enkel regel på tre göras för att beräkna mol som finns i 1000 ml av nämnda lösning
Om det finns 250 ml lösning i> 250 ml lösning
I 1000 ml lösning => x Hur många mol finns det?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
En annan väg
Det andra sättet att erhålla mol för att tillämpa formeln kräver att 250 ml tas till liter, även med en regel om tre:
Om 1000 ml => är 1 liter
250 ml => x Hur många liter är?
x = (250 ml) (1 liter) / 1000 ml
x = 0,25 L.
Ersätter sedan i molaritetsformeln:
M = (0,61 mol löst ämne) / (0,25 L lösning)
M = 2,44 mol / l
Övning 2
Vad betyder det för en HCl-lösning att vara 2,5 M.?
HCl-lösningen är 2,5 molar, det vill säga en liter av den har löst upp 2,5 mol saltsyra..
Vanligt
Normaliteten eller motsvarande koncentration är den enhet för kemisk koncentration av de lösningar som anges med stor bokstav N. Denna koncentrationsenhet indikerar lösningsmedlets reaktivitet och är lika med antalet ekvivalenter lösta ämnen (ekv.) Mellan lösningsvolymen uttryckt i liter.
N = Eq / L
Antalet ekvivalenter (Eq) är lika med gram löst ämne dividerat med motsvarande vikt (PEq).
Eq = g löst / PEq
Den ekvivalenta vikten, eller även känd som gramekvivalenten, beräknas genom att erhålla den upplösta molekylvikten och dividera den med en ekvivalent faktor som för att sammanfatta i ekvationen kallas delta zeta (AZ).
PEq = PM / AZ
Beräkning
Beräkningen av normalitet kommer att ha en mycket specifik variation i ekvivalentfaktorn eller AZ, som också beror på vilken typ av kemisk reaktion som den lösta eller reaktiva arten deltar i. Några fall av denna variation kan nämnas nedan:
-När det gäller en syra eller bas kommer AZ eller ekvivalent faktor att vara lika med antalet vätejoner (H+) eller hydroxyl OH- det har lösningen. Till exempel svavelsyra (HtvåSW4) har två ekvivalenter eftersom den har två sura protoner.
-När det gäller oxidationsreduktionsreaktioner kommer ΔZ att motsvara antalet elektroner som är involverade i oxidations- eller reduktionsprocessen, beroende på det specifika fallet. Det är här balanseringen av kemiska ekvationer och specifikationen av reaktionen spelar in..
-På samma sätt motsvarar denna ekvivalenta faktor eller AZ antalet joner som utfälls i reaktioner som klassificeras som utfällning..
Övning 1
Bestäm normaliteten på 185 g NatvåSW4 finns i 1,3 liter lösning.
Molekylvikten för det lösta ämnet i denna lösning beräknas först:
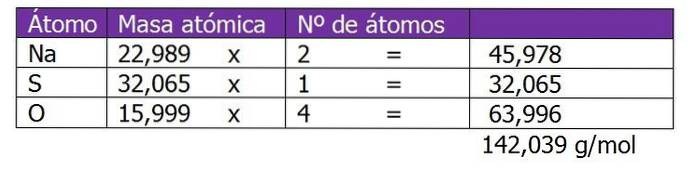
Det andra steget är att beräkna ekvivalentfaktorn eller AZ. I detta fall, eftersom natriumsulfat är ett salt, kommer valansen eller laddningen av katjonen eller metallen Na att övervägas.+, som kommer att multipliceras med 2, vilket är abonnemanget för den kemiska formeln salt eller löst ämne:
NatvåSW4 => ∆Z = Valencia katjon x prenumeration
∆Z = 1 x 2
För att erhålla motsvarande vikt ersätts den i sin respektive ekvation:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / ekv
Och sedan kan du fortsätta att beräkna antalet ekvivalenter, återigen använda en annan enkel beräkning:
Eq = (185 g) / (71,02 g / Eq)
Antal ekvivalenter = 2.605 Ekv
Slutligen, med alla nödvändiga data, beräknas normaliteten nu genom att ersätta enligt dess definition:
N = 2,605 Ekv / 1,3 L
N = 2,0 N
Molalitet
Molalitet betecknas med gemener m y är lika med molen löst ämne som finns i ett (1) kg lösningsmedel. Det är också känt som molal koncentration och beräknas med hjälp av följande formel:
m = mol löst ämne / kg lösningsmedel
Medan molaritet fastställer förhållandet mellan mol upplösta ämnen som finns i en (1) liter av lösningen, relaterar molaliteten mol upplösta ämnen som finns i ett (1) kg lösningsmedel.
I de fall då lösningen bereds med mer än ett lösningsmedel kommer molaliteten att uttrycka samma mol löst ämne per kilo lösningsmedelsblandningen..
Övning 1
Bestäm molaliteten för en lösning som framställdes genom att blanda 150 g sackaros (C12H220elva) med 300 g vatten.
Molekylvikten för sackaros bestäms först för att fortsätta beräkningen av mol löst ämne i denna lösning:
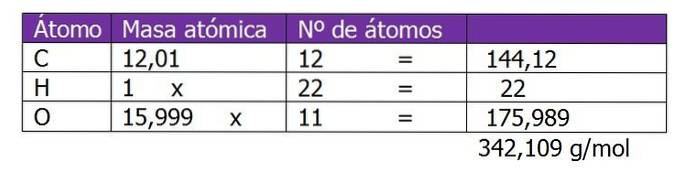
Antalet mol sackaros beräknas:
n = (150 g sackaros) / (342,109 g / mol)
n = 0,438 mol sackaros
Därefter tas gram lösningsmedel till kilo för att kunna tillämpa den slutliga formeln.
Ersätter sedan:
m = 0,438 mol sackaros / 0,3 kg vatten
m = 1,46 mol C12H220elva/ Kg HtvåELLER
Även om det för närvarande diskuteras om det slutliga uttrycket för molalitet kan detta resultat också uttryckas som:
1,26 m C12H220elva eller 1,26 molal
Ibland anses det fördelaktigt att uttrycka koncentrationen av lösningen i termer av molalitet, eftersom massorna av lösningsmedlet och lösningsmedlet inte lider av små fluktuationer eller oförändrade förändringar på grund av effekterna av temperatur eller tryck; som det händer i lösningar med gasformigt löst ämne.
Dessutom påpekas att denna koncentrationsenhet som hänvisas till en specifik lösning är oförändrad av förekomsten av andra lösta ämnen i lösningen..
Rekommendationer och viktiga anmärkningar om kemisk koncentration
Lösningsvolymen är alltid större än lösningsmedlets volym
När lösningsövningarna löses uppstår felet att tolka volymen på en lösning som om den vore lösningsmedlets. Till exempel, om ett gram pulveriserad choklad löses i en liter vatten, är volymen av lösningen inte lika stor som för en liter vatten..
Varför inte? Eftersom det lösta ämnet alltid upptar utrymme mellan lösningsmedelsmolekylerna. När lösningsmedlet har hög affinitet för lösningsmedlet kan volymförändringen efter upplösning vara försumbar eller försumbar..
Men om inte, och ännu mer om mängden löst ämne är stor, måste volymförändringen beaktas. Att vara så här: Vsolvent + Vsolute = Vsolution. Endast i utspädda lösningar eller där mängden löst ämne är liten gäller Vsolvent = Vsolution.
Detta fel måste komma ihåg, särskilt när man arbetar med flytande lösta ämnen. Till exempel, om honung löses i alkohol istället för att lösa pulveriserad choklad, kommer volymen tillsatt honung att ha betydande effekter på den totala volymen av lösningen..
I dessa fall måste därför lösningsmedlets volym läggas till lösningsmedlets volym..
Utnyttjande av molaritet
-Att känna till molariteten hos en koncentrerad lösning gör att utspädningsberäkningar kan utföras med den enkla formeln M1V1 = M2V2, där M1 motsvarar den initiala molariteten för lösningen och M2 molariteten för lösningen som ska beredas från lösningen M1.
-Med kännedom om en lösnings molaritet kan dess normalitet enkelt beräknas med hjälp av följande formel: Normalitet = antal ekvivalenter x M
Formlerna sparas inte utan enheterna eller definitionerna är det
Ibland misslyckas dock minnet med alla ekvationer som är relevanta för koncentrationsberäkningar. För detta är det mycket användbart att ha en mycket tydlig definition av varje koncept.
Från definitionen skrivs enheterna med hjälp av omvandlingsfaktorer att uttrycka de som motsvarar vad du vill bestämma.
Till exempel, om du har molalitet och vill konvertera den till normal, gör så här:
(mol / kg lösningsmedel) x (kg / 1000 g) (g lösningsmedel / ml) (ml lösningsmedel / ml lösning) (1000 ml / L) (Ekv / mol)
Observera att (g lösningsmedel / ml) är lösningsmedlets densitet. Termen (ml lösningsmedel / ml lösning) avser hur mycket volym av lösningen som faktiskt motsvarar lösningsmedlet. I många övningar är denna sista term lika med 1, av praktiska skäl, även om det aldrig är helt sant..
Referenser
- Inledningskemi - 1st Kanadensisk utgåva. Kvantitativa koncentrationsenheter. Kapitel 11 Lösningar. Hämtad från: opentextbc.ca
- Wikipedia. (2018). Motsvarande koncentration. Hämtad från: en.wikipedia.org
- PharmaFactz. (2018). Vad är molaritet? Hämtad från: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 101-103, 512, 513.
- Vattenlösningar-molaritet. Hämtad från: chem.ucla.edu
- Quimicas.net (2018). Exempel på normalitet. Återställd från: quimicas.net.



Ingen har kommenterat den här artikeln än.