
Antoines konstanter formler, ekvationer, exempel
De Antoines konstanter är tre parametrar som visas i ett empiriskt förhållande mellan mättnadsångtryck och temperatur för rena ämnen. De beror på varje ämne och antas vara konstanta inom ett visst temperaturintervall.
Utanför det intervallet ändrar Antoines konstanter sitt värde. Konstanterna är relaterade till en ekvation skapad 1888 av den franska ingenjören Louis Charles Antoine (1825-1897).
Artikelindex
- 1 Formler och ekvationer
- 2 Mättnadsånga
- 3 Hur beräknas Antoines konstanter??
- 4 Exempel
- 4.1 Exempel 1
- 4.2 Exempel 2
- 4.3 Lösning
- 5 Referenser
Formler och ekvationer
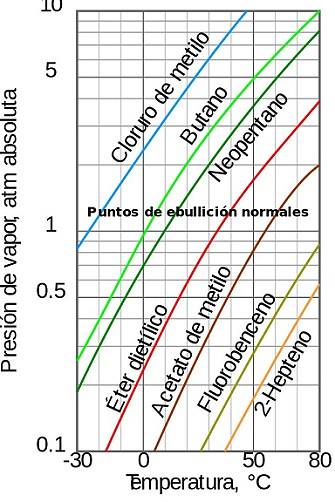
Det vanligaste sättet att uttrycka Antoine-funktionen är:
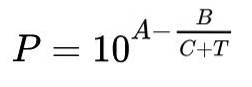
I denna formel representerar P mättnadens ångtryck uttryckt i millimeter kvicksilver (mmHg), T är temperaturen som har varit den oberoende variabeln och uttrycks i ℃.
A, B och C är konstanterna eller parametrarna för Antoins formel.
Vikten av denna formel, som trots att den är empirisk, ger ett enkelt analytiskt uttryck som lätt kan användas i termodynamiska beräkningar..
Antoines formel är inte unik, det finns mer exakta uttryck som är förlängningar av denna formel, men med nackdelen att de har sex eller flera parametrar och deras matematiska uttryck är mer komplicerat, vilket gör dem opraktiska att använda i termodynamiska beräkningar..
Mättnadsånga
Eftersom Antoines formel mäter mättnadens ångtryck är det nödvändigt att förklara vad den består av.
En vätska placeras i en glasampull eller annan behållare. All luft avlägsnas från blåsan. Enheten placeras i ett termiskt bad tills jämvikt uppnås..
I början är allt flytande, men eftersom det finns ett vakuum börjar de snabbare molekylerna lämna vätskan och bilda en gas av samma ämne som vätskan..
Ovanstående process är avdunstning och när det händer ökar ångtrycket.
Några av ångmolekylerna tappar energi och återansluter sig till vätskans fas, detta är processen för kondensation.
Sedan inträffar två processer samtidigt, avdunstning och kondens. När ett lika stort antal molekyler kommer ut ur vätskan som de införlivas i, a dynamisk balans och vid detta ögonblick inträffar det maximala ångtrycket som kallas mättnadstryck.
Det är detta ångmättnadstryck som Antoines formel förutsäger för varje ämne och varje temperatur..
I vissa fasta ämnen inträffar ett liknande fenomen när man går från den fasta fasen till den gasformiga fasen direkt utan att gå igenom vätskefasen, i dessa fall kan ett mättnadsångtryck också mätas.
Det är inte lätt att upprätta en teoretisk modell med utgångspunkt från de första principerna eftersom förändringar i molekylär kinetisk energi är inblandade, vilka kan vara translationella, roterande och vibrerande, med den inre energin för molekylär bindning. Det är av denna anledning som i praktiken används empiriska formler.
Hur beräknas Antoines konstanter??
Det finns ingen teoretisk metod för att få Antoines konstanter, eftersom det är ett empiriskt förhållande.
De erhålls från experimentella data för varje substans och justerar de tre parametrarna A, B och C, så att de minimerar den kvadratiska skillnaden (metoden för minsta kvadrater) av förutsägelsen med experimentdata..
För slutanvändaren, som i allmänhet är kemitekniker, finns det tabeller i kemihandböckerna där dessa konstanter anges för varje ämne, som anger de högsta och lägsta temperaturintervallerna i vilka de är tillämpliga..
Det finns också tillgängliga onlinetjänster som ger värdena för konstanterna A, B och C, vilket är fallet med DDBST GmbH Onlines tjänster.
Det kan finnas mer än ett giltigt temperaturintervall för samma ämne. Beroende på arbetsområde väljs sedan en eller annan grupp konstanter.
Svårigheter kan uppstå om temperaturområdet för arbetsområdet ligger mellan två konstanta giltighetsområden, eftersom tryckförutsägelserna med formeln inte sammanfaller i gränszonen.
Exempel
Exempel 1
Hitta ångtrycket hos vatten vid 25 ℃.
Lösning
Vi konsulterar tabellerna för att bestämma konstanterna för Antoine.
Det finns två områden för vatten:
Mellan 1 ℃ och 100 ℃ och mellan 99 ℃ upp till 374 ℃.
Eftersom vi är intresserade av 25 take tar vi det första intervallet där värdet av Antoines konstanter är:
A = 8,07131
B = 1730,63
C = 233,426
P = 10 ^ (8.07131 - 1730.63 / (25 + 233.426))
Beräkning av exponenten
Låt oss först beräkna exponenten: 1.374499
P = 10 ^ 1,374499 = 23,686 mmHg = 0,031166 atm
Resultatanalys
Dessa resultat tolkas så här:
Antag att rent vatten placeras i en lufttät behållare från vilken luften har avlägsnats med hjälp av en vakuumpump..
Behållaren med vattnet placeras i ett termiskt bad vid en temperatur av 25 ℃ tills det når termisk jämvikt..
Vattnet i den hermetiska behållaren förångas delvis tills det når mättnadsångtrycket, vilket är inget annat än det tryck vid vilket den dynamiska jämvikten mellan vattenvätskans fas och ångfasen upprättas..
Det trycket i detta fall visade sig vara 0,031166 atm vid 25 ℃.
Exempel 2
Hitta ångtrycket hos vatten vid 100 ℃.
Lösning
Vi konsulterar tabellerna för att bestämma Antoines konstanter. Det finns två områden för vatten:
Mellan 1 ℃ och 100 ℃ och mellan 99 ℃ upp till 374 ℃.
I detta fall ligger temperaturen av intresse inom de två områdena.
Vi använder det första av intervallen [1 ℃, 100 ℃]
A = 8,07131
B = 1730,63
C = 233,426
P = 10 ^ (8.07131 - 1730.63 / (100 + 233.426))
Beräkning av exponenten
Låt oss först beräkna exponenten: 2.8808
P = 10 ^ 1,374499 = 760,09 mmHg = 1 0001 atm
Därefter använder vi det andra av intervallen [99 ℃, 374 ℃]
I det här fallet är konstanterna det
A = 8.14019
B = 1810,94
C = 244,485
P = 10 ^ (8.14019 - 1810.94 / (100 + 244.485))
Låt oss först beräkna exponenten: 2.88324
P = 10 ^ 2.88324 = 764.2602 mmHg = 1.0056 atm
Det finns en procentuell skillnad mellan de två resultaten på 0,55%.
Referenser
- Tillämpning av Raoult och Daltons lagar och Antoines ekvation. Återställd från: misapuntesyantación.wordpress.com
- Antoines formel online-kalkylator. Återställd från: ddbonline.ddbst.de/AntoineCalculation/AntoineCalculationCGI.exe
- Gecousb. Termodynamik och ångbord / Antoines konstanter. Återställd från: gecousb.com.ve
- Termiska egenskaper hos materia. Återställd från: webserver.dmt.upm.es
- Yaws och Yang. Antoine-konstanttabeller för över 700 organiska föreningar. Återställd från: user.eng.umd.edu
- Wikipedia. Antoines ekvation. Återställd från wikipedia.com
- Wikipedia. Clausius-Clapeyron ekvation. Återställd från wikipedia.com
- Wisniak J. Historisk utveckling av ångtrycksekvationen från dalton till antoine. Återställd från: link.springer.com


Ingen har kommenterat den här artikeln än.