
Natriumdodecylsulfat (SDS) struktur, egenskaper, användningsområden
De natriumdodecylsulfat (SDS), är ett anjoniskt, syntetiskt och amfifilt organiskt salt. Den apolära och hydrofoba delen motsvarar kolvätekedjan; medan den polära och hydrofila delen beror på sulfat, med en negativ laddning.
SDS är ett ytaktivt medel: dess molekyler placeras på ytan av vattenlösningar, vilket ger en minskning av ytspänningen. Denna funktion gör att den kan användas i schampo, tandkräm, tvål och annan personlig vård och hushållsrengöringsmedel..
Sodiumdodecylsulfat binder till proteinet och producerar dess utveckling och får en långsträckt form. Sulfatgrupperna exponeras för vatten och får negativa laddningar, vars antal är proportionellt mot deras molekylvikt..
Av denna anledning tillåter SDS bestämning av molekylvikterna hos proteiner genom polyakrylamidelektrofores..
Även om en möjlig cancerframkallande effekt av SDS har misstänks har det inte visat sig vara slutgiltigt. Säkerhetsdatablad kan orsaka hud- och ögonirritation som andra tvättmedel..
Artikelindex
- 1 Uppbyggnad av säkerhetsdatabladet
- 1.1 Kristaller
- 1.2 Miceller
- 2 fastigheter
- 2.1 Namn
- 2.2 Molekylformel
- 2.3 Molmassa
- 2.4 Fysisk beskrivning
- 2,5 Lukt
- 2.6 Smältpunkt
- 2.7 Löslighet i vatten
- 2.8 Densitet
- 2.9 Stabilitet
- 2.10 Sönderdelning
- 2.11 Ytspänning
- 2.12 Kritisk molkoncentration
- 3 användningsområden
- 3.1 Personlig vård och städning hemma
- 3.2 Veterinärmedicin och humanmedicin
- 3.3 I laboratoriet
- 3.4 Livsmedelstillsats
- 3.5 Industri
- 4 risker
- 5 Referenser
Säkerhetsdatabladets struktur
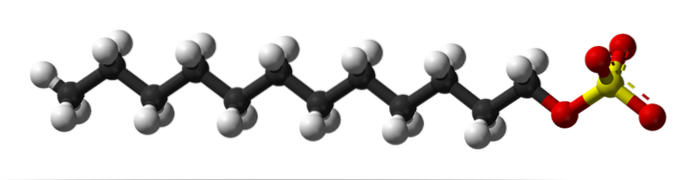
I den första bilden visades SDS-molekylen med en sfär- och stavmodell. Som framgår har den en hydrofob och opolerad kolsyrad svans (svarta och vita kulor); och samtidigt ett polarhuvud tack vare närvaron av gruppen -SO4- (gula och röda sfärer).
Även om det inte visas bör det finnas en lila sfär som representerar Na-katjonen+, precis bredvid -SO-gruppen4-, interagerar elektrostatiskt.
Med detta sagt är det lätt att se varför denna förening är amfifil; och även ett anjoniskt ytaktivt medel, eftersom laddningen av SDS är negativ och kan locka andra katjoner utöver Na+.
Molekylen ger ett felaktigt intryck av att vara styv, en orörlig linjär struktur. Det är dock tvärtom. Säkerhetsdatabladet kunde jämföras med en "mask", vars kolsyrade svans uppvisar flera vibrationer och rotationer av sina enskilda bindningar. Detta gör att den kan anta olika former eller veck i mitten; i vatten, till exempel.
Kristaller
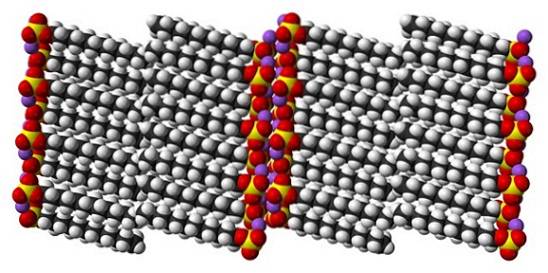
Även om det är sant att natriumdodecylsulfat är en dynamisk molekyl, behöver den i fast tillstånd inte röra sig för mycket, och beter sig som en "enkel" stav. Och sålunda är varje molekyl eller stapel placerad på ett sådant sätt att interaktionen mellan karbonatsvansarna ökar och samtidigt deras joniska laddningar..
Resultatet är bildandet av en monoklinisk kristall, där SDS-molekylerna packas i flera kolumner av staplar (toppbild). De intermolekylära krafterna som binder dem är sådana att dessa kristaller kräver en temperatur på 206 ° C för att smälta in i vätskefasen..
Micelles
Utanför kristallens komfort kan SDS-molekylen inte längre sitta still; börjar vrida svansen för att öka eller minska interaktioner med omgivningen.
Om detta medium är vatten inträffar ett fenomen som kallas micellbildning: de kolsyrade och hydrofoba svansarna förenas för att beväpna varandra, medan polhuvudena, -SO-grupperna4-, förblir på ytan som interagerar med H-molekylertvåELLER.
Micellen får sedan en oblat ellipsoid morfologi (som jorden, men mer platt). I glaset är de som block av staplar och i ett vattenhaltigt medium som ellipsoida miceller. Vad händer om mediet var oljigt? Micellen skulle vändas: polarhuvudena SO4- skulle gå till kärnan, medan deras kolsyrade svansar skulle utsättas för oljan.
Egenskaper
Namn
- Sodium dodecyl sulfate (SDS).
- Sodium Lauryl Sulfate (SLS).
Molekylär formel
C12H25ELLER4SNa.
Molmassa
288,378 g / mol.
Fysisk beskrivning
Olika presentationer: torrt pulver, flytande eller vått fast ämne. Dess kristaller har en vit eller krämig färg.
Odör
Svag lukt av feta ämnen, luktfri.
Smältpunkt
206 ºC.
Vattenlöslighet
1 105 mg / L. 1 g löst i 10 ml av en opaliserande lösning.
Densitet
1,01 g / cm3.
Stabilitet
Stabil under rekommenderade lagringsförhållanden.
Sönderfall
Vid uppvärmning till nedbrytning avger den en vit rök av svaveloxid och natriumoxid.
Ytspänning
39,5 dyn / cm vid 25 ° C.
Kritisk molkoncentration
Det är 8,2 mM i rent vatten vid 25 ºC.
Applikationer
Personlig vård och hemstädning
Dodecylsulfat är ett ytaktivt medel som används i många produkter, såsom handtvålar, skumbad, rakkrämer etc. Det används också för att ta bort fläckar som är svåra att ta bort från kläder, rengöra golv och badrum, skrubba köksartiklar etc..
Veterinärmedicin och humanmedicin
Det används som ett avstötningsmedel för loppor och fästingar som finns hos djur. Det används också som fuktighetsbevarande medel i vissa antibiotika, för oral eller lokal användning..
SDS är mikrobicid mot höljesvirus, såsom HIV, typ 1 och 2, och herpes simplex-viruset (HSV-2). Det verkar också på icke-omhöljda virus: papillomavirus, reovirus, rotavirus och poliovirus. Denna användning är dock inte godkänd..
Användningen av SDS som en dusch har föreslagits för att ge skydd mot sexuellt överförbara virus. Vid bearbetning av bröstmjölk för att eliminera eller minska risken för HIV-överföring via amning.
Förutom dess antivirala verkan verkar SDS på patogena bakterier och svampar. SDS tar bort läkemedelsresistens och könsöverföringsfaktorer från E. coli; och blockerar tillväxten av många gram-positiva bakterier.
På laboratoriet
SDS binder till proteiner som orsakar deras denaturering och förser dem med negativa laddningar och en konformationsförändring. Detta möjliggör bestämning av deras molekylvikter med polyakrylamidelektrofores..
SDS används också vid framställning av hjärnvävnadsprover för användning i ljusmikroskopi. Det används också vid beredning av blodprover för att räkna antalet erytrocyter..
SDS används vid rening av nukleinsyror på grund av dess förmåga att lösa upp membran och dess hämmande verkan på aktiviteten hos RNase- och DNase-enzymer.
Dessutom används SDS vid karakterisering av kvartära ammoniumföreningar..
Livsmedelstillsats
SDS används som emulgeringsmedel och förtjockningsmedel i livsmedel. Förbättrar stabiliteten och strukturen hos bakverk. Dessutom används den som hjälpmedel för att slå torra äggprodukter..
Industri
SDS används inom elektropläteringsindustrin, särskilt nickel och zink; som emulgeringsmedel och penetrerande i lack och färgborttagare; i beredningen av sprutgjutna sprutämnen; och i fasta raketdrivmedel som skummedel.
Risker
Konstant exponering för SDS kan orsaka hyperplasi hos marsvin. Kaniner och människor är mindre mottagliga för dessa skador. Direktkontakt med SDS i en koncentration ≤ 20%, kan orsaka måttlig inflammation och hudirritation.
Å andra sidan kan långvarig exponering för SDS orsaka dermatit med tecken på rodnad, svullnad och blåsor..
Säkerhetsdatablad kan orsaka ögonirritation vid kontakt. Det kan också vara mycket reaktivt hos vissa människor och orsaka irritation i luftvägarna och andningsbesvär genom inandning..
I sällsynta fall kan intag av SDS orsaka kaustisk skada. Men det har rapporterats hos barn som har intagit SDS, snabbt utvecklande kräkningar, CNS-depression och andningssvårigheter..
Inga bevis för genotoxicitet eller teratogen verkan har hittats i SDS. Hos 242 patienter med eksematös dermatit befanns 6,4% av patienterna ha en allergi, som kan hänföras till användningen av SDS.
Referenser
- Strukturella data från L. A. Smith, R. B. Hammond, K. J. Roberts, D. Machin, G. McLeod (2000). Bestämning av kristallstrukturen hos vattenfritt natriumdodecylsulfat med användning av en kombination av synkrotronstrålningspulverdiffraktion och molekylär modelleringsteknik. Journal of Molecular Structure 554 (2-3): 173-182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Natriumdodecylsulfat. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Natriumdodecylsulfat. PubChem-databas. CID = 3423265. Återställd från: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Temperatureffekt på nanostrukturen hos SDS Micelles i vatten. Tidskrift för forskning från National Institute of Standards and Technology, 118, 151-167. doi: 10.6028 / jres.118.008
- Elsevier. (2019). Sodium Dodecyl Sulfate. Science Direct. Återställd från: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. och Tsipila, T. (2014). Toxikologiska effekter av natriumdodecylsulfat. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Toxicology Data Network. (s.f.). Natriumlaurylsulfat. Toxnet. Återställd från: toxnet.nlm.nih.gov



Ingen har kommenterat den här artikeln än.