
Kemisk aktiveringsenergi Vad består den av, Beräkning

De kemisk aktiveringsenergi (ur synvinkel av kinetiska studier) avser minst möjlig mängd energi som krävs för att starta en kemisk reaktion. Enligt teorin om kollisioner i kemisk kinetik sägs alla molekyler som är i rörelse ha en viss mängd kinetisk energi.
Detta betyder att ju större hastighet på dess rörelse, desto större är dess kinetiska energi. I den meningen kan en molekyl som bär en snabb rörelse inte delas in i fragment av sig själv, så en kollision måste inträffa mellan den och en annan molekyl för att en kemisk reaktion ska kunna äga rum..
När detta händer - när det finns en kollision mellan molekylerna - omvandlas en bråkdel av deras kinetiska energi till vibrationsenergi. På samma sätt, om den kinetiska energin i början av processen är hög, kommer de molekyler som deltar i kollisionen att presentera en så stor vibration att vissa av de kemiska bindningarna som är närvarande kommer att brytas..
Denna brytning av bindningar utgör det första steget i omvandlingen av reaktanter till produkter; det vill säga i bildandet av dessa. Tvärtom, om den kinetiska energin i början av denna process är av liten storlek kommer det att finnas ett fenomen med "rebound" av molekylerna, genom vilka de separeras praktiskt taget intakta..
Artikelindex
- 1 Vad gör?
- 1.1 Aktiverat komplex
- 2 Hur beräknas det?
- 2.1 Beräkning av aktiveringsenergin för en kemisk reaktion
- 3 Hur påverkar aktiveringsenergi hastigheten för en reaktion?
- 4 Exempel på beräkning av aktiveringsenergi
- 5 Referenser
Vad består det av?
Med utgångspunkt från begreppet kollisioner mellan molekyler för att initiera kemiska reaktioner som tidigare beskrivits, kan man säga att det krävs en minimal mängd energi för att en kollision ska inträffa..
Så om energivärdet är mindre än detta nödvändiga minimum, kommer det helt enkelt inte att ske någon förändring mellan molekylerna efter kollisionen, vilket innebär att när denna energi är frånvarande förblir de involverade arterna praktiskt taget intakta och det kommer inte att hända. på grund av denna krasch.
I denna idéordning kallas den minsta energi som behövs för att en förändring ska kunna inträffa efter en kollision mellan molekyler aktiveringsenergin..
Med andra ord måste molekylerna som är involverade i en kollision ha en total mängd kinetisk energi som är lika med eller större än aktiveringsenergin för att en kemisk reaktion ska inträffa..
På samma sätt kolliderar molekylerna i många fall och härrör från en ny art som kallas det aktiverade komplexet, en struktur som också kallas "övergångstillståndet" eftersom det bara existerar tillfälligt..
Det orsakas av reaktantspecies på grund av kollisionen och före bildandet av reaktionsprodukterna.
Aktiverat komplex
Det aktiverade komplexet som nämns ovan bildar en art som har mycket låg stabilitet men i sin tur har en stor potential av potentiell energi..
Följande diagram visar transformationen av reaktanter till produkter, uttryckt i termer av energi och noterar att storleken på energin hos det aktiverade komplexet som bildas är betydligt större än reaktanterna och produkterna..
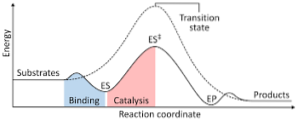
Om produkterna i slutet av reaktionen har större stabilitet än de reaktanta ämnena, sker frisättningen av energi i form av värme, vilket ger en exoterm reaktion..
Tvärtom, om reaktanterna resulterar i en större stabilitet än produkterna, betyder det att reaktionsblandningen uppvisar en absorption av energi i form av värme från sin omgivning, vilket resulterar i en endoterm reaktion..
På samma sätt, om det ena eller det andra fallet händer, bör ett diagram som det som visats tidigare konstrueras, där den potentiella energin i systemet som reagerar mot reaktionens framsteg eller framsteg planeras..
Således erhålls de potentiella energiförändringarna som inträffar när reaktionen fortskrider och reaktanterna omvandlas till produkter..
Hur beräknas det?
Aktiveringsenergin för en kemisk reaktion är nära relaterad till hastighetskonstanten för nämnda reaktion, och beroendet av denna konstant med avseende på temperatur representeras av Arrhenius-ekvationen:
k = Ae-Ea / RT
I detta uttryck k representerar reaktionens hastighetskonstant (som beror på temperaturen) och parametern TILL kallas frekvensfaktorn och är ett mått på frekvensen av kollisioner mellan molekyler.
För hans del, och uttrycker basen för serien av naturliga logaritmer. Den höjs till en effekt som är lika med den negativa kvoten för aktiveringsenergin (Ea) mellan produkten som härrör från gaskonstanten (R) och absolut temperatur (T) av systemet att överväga.
Det bör noteras att frekvensfaktorn kan betraktas som en konstant i vissa reaktionssystem över ett brett temperaturintervall..
Detta matematiska uttryck antogs ursprungligen av den nederländska kemisten Jacobus Henricus van't Hoff 1884, men den som gav den vetenskaplig giltighet och tolkade dess förutsättning var den svenska kemisten Svante Arrhenius 1889.
Beräkning av aktiveringsenergin för en kemisk reaktion
Arrhenius-ekvationen specificerar den direkta proportionaliteten som existerar mellan hastigheten konstant för en reaktion och frekvensen av kollisioner mellan molekyler.
På samma sätt kan denna ekvation representeras på ett mer bekvämt sätt genom att tillämpa egenskapen hos naturliga logaritmer på varje sida av ekvationen och erhålla:
ln k = ln A - Ea / RT
Genom att ordna om termerna när det gäller att erhålla ekvationen för en linje (y = mx + b) uppnås följande uttryck:
ln k = (- Ea / R) (1 / T) + ln A
Så, när man konstruerar en graf för lnk mot 1 / T, erhålls en rak linje, där lnk representerar koordinaten och, (-Ea / R) representerar lutningen för linjen (m), (1 / T) representerar x-koordinaten och ln A representerar avlyssningen med ordinataxeln (b).
Som framgår är lutningen som härrör från denna beräkning lika med värdet av -Ea / R. Detta innebär att om du vill erhålla värdet på aktiveringsenergin med hjälp av detta uttryck, måste du göra en enkel förtydligande av detta, vilket resulterar i:
Ea = -mR
Här är värdet på m känt och R är en konstant lika med 8,314 J / K mol.
Hur påverkar aktiveringsenergi reaktionshastigheten??
När man försöker få en bild av aktiveringsenergin kan den betraktas som en barriär som inte tillåter en reaktion mellan de lägre energimolekylerna..
Som i en vanlig reaktion händer det att antalet molekyler som kan reagera är ganska stort, hastigheten - och motsvarande, den kinetiska energin hos dessa molekyler - kan vara mycket varierande.
Det händer i allmänhet att endast en liten mängd av de totala molekylerna som upplever en kollision - de som har större rörelsehastighet - har tillräckligt med kinetisk energi för att kunna överstiga aktiveringsenergins storlek. Så dessa molekyler är lämpliga och kan vara en del av reaktionen.
Enligt Arrhenius-ekvationen innebär det negativa tecknet - som föregår kvoten mellan aktiveringsenergin och produkten av gaskonstanten och den absoluta temperaturen - att hastighetskonstanten minskar när det sker en ökning av aktiveringsenergin, liksom en tillväxt när temperaturen ökar.
Exempel på beräkning av aktiveringsenergi
För att beräkna aktiveringsenergin genom att konstruera en graf, enligt Arrhenius-ekvationen, har hastighetskonstanterna för nedbrytningsreaktionen av acetaldehyd mätt vid fem olika temperaturer och det är önskvärt att bestämma aktiveringsenergin för reaktionen, vilken uttrycks som:
CH3CHO (g) → CH4(g) + CO (g)
Uppgifterna för de fem mätningarna är som följer:
k (1 / M1/2S): 0,011 - 0,035 - 0,105 - 0,334 - 0,789
T (K): 700-730-760-790-810
För det första, för att lösa detta okända och bestämma aktiveringsenergin, måste en graf av ln k vs 1 / T (y vs x) konstrueras, för att få en rak linje och härifrån ta lutningen och hitta värdet av Ea , som förklarats.
Omvandling av mätdata, enligt Arrhenius-ekvationen [ln k = (- Ea / R) (1 / T) + ln A], finns följande värden för y respektive x:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-11,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Från dessa värden och med den matematiska beräkningen av lutningen - antingen i en dator eller i en räknare, med hjälp av uttrycket m = (Ytvå-Y1) / (Xtvå-X1) eller med linjär regressionsmetod - erhålls att m = -Ea / R = -2,09 * 104 K. Således:
Ea = (8,314 J / K mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 10två kJ / mol
För att bestämma andra aktiveringsenergier genom det grafiska sättet utförs en liknande procedur.
Referenser
- Wikipedia. (s.f.). Aktiverings energi. Återställd från en.wikipedia.org
- Chang, R. (2007). Chemistry, nionde upplagan. Mexiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktiverings energi. Hämtad från britannica.com
- Moore, J. W. och Pearson, R. G. (1961). Kinetik och mekanism. Återställd från books.google.co.ve
- Kaesche, H. (2003). Korrosion av metaller: fysikalisk-kemiska principer och nuvarande problem. Erhålls från books.google.co.ve


Ingen har kommenterat den här artikeln än.