
Absorptionsspektrum atomisk, synlig och molekylär absorption
A Absorptionsspektrum Det är produkten av växelverkan mellan ljus och ett material eller ämne i något av dess fysiska tillstånd. Men definitionen går utöver ett enkelt synligt ljus, eftersom interaktionen inkluderar ett brett segment av våglängderna och energin för elektromagnetisk strålning..
Därför kan vissa fasta ämnen, vätskor eller gaser absorbera fotoner med olika energier eller våglängder; från ultraviolett strålning, följt av synligt ljus, till strålning eller infrarött ljus, som går in i mikrovågsvåglängder.

Det mänskliga ögat uppfattar bara interaktioner mellan materia och synligt ljus. På samma sätt kan den överväga diffraktionen av vitt ljus genom ett prisma eller ett medium i dess färgstarka komponenter (övre bild).
Om ljusstrålen "fångades" efter att ha rest genom ett material och analyserat, skulle frånvaron av vissa färgband hittas; det vill säga svarta ränder skulle observeras i kontrast till dess bakgrund. Detta är absorptionsspektrumet, och dess analys är grundläggande inom instrumental analytisk kemi och astronomi..
Artikelindex
- 1 Atomabsorption
- 1.1 Övergångar och elektroniska energier
- 2 Synligt spektrum
- 3 Absorptionsspektrum av molekyler
- 3.1 Metylenblått
- 3.2 Klorofyll a och b
- 4 Referenser
Atomabsorption
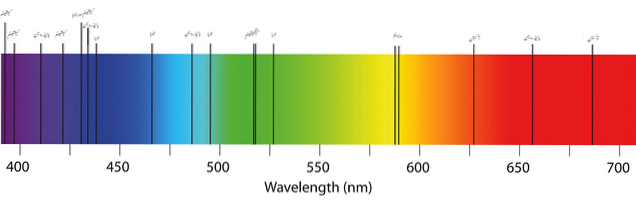
Den övre bilden visar ett typiskt absorptionsspektrum för elementen eller atomerna. Observera att de svarta banden representerar de absorberade våglängderna, medan de andra är de emitterade. Detta innebär att ett atomemissionsspektrum däremot skulle se ut som ett svart band med ränder av emitterade färger..
Men vad är dessa ränder? Hur vet jag kort om atomerna absorberar eller avger (utan att införa fluorescens eller fosforesens)? Svaren ligger i atomernas tillåtna elektroniska tillstånd.
Elektroniska övergångar och energier
Elektroner kan röra sig bort från kärnan och lämna den positivt laddad medan de passerar från en orbital med lägre energi till en högre energi. För detta, förklarat av kvantfysik, absorberar de fotoner av en specifik energi för att genomföra nämnda elektroniska övergång..
Därför kvantiseras energin, och de absorberar inte hälften eller tre fjärdedelar av en foton, utan specifika frekvensvärden (ν) eller våglängder (λ).
När elektronen är upphetsad stannar den inte i obegränsad tid i det elektroniska tillståndet med högre energi; frigör energin i form av en foton, och atomen återgår till sitt basala eller ursprungliga tillstånd.
Beroende på om de absorberade fotonerna registreras, kommer ett absorptionsspektrum att erhållas; och om de emitterade fotonerna spelas in blir resultatet ett emissionsspektrum.
Detta fenomen kan observeras experimentellt om gasformiga eller finfördelade prover av ett element värms upp. I astronomi kan man, genom att jämföra dessa spektra, känna till en stjärnas sammansättning och till och med dess läge i förhållande till jorden..
Synligt spektrum
Som framgår av de två första bilderna inkluderar det synliga spektrumet färger från violett till rött och alla deras nyanser angående hur mycket materialet absorberar (mörka nyanser).
Våglängderna för rött ljus motsvarar värden från 650 nm och framåt (tills de försvinner i infraröd strålning). Och längst till vänster täcker de violetta och lila tonerna våglängdsvärdena upp till 450 nm. Det synliga spektrumet sträcker sig sedan från 400 till 700 nm ungefär.
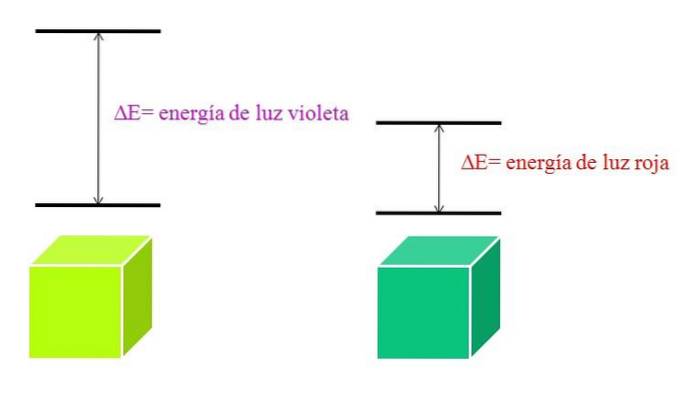
När λ ökar minskar fotonens frekvens och därmed dess energi. Således har violett ljus högre energi (kortare våglängder) än rött ljus (längre våglängder). Därför involverar ett material som absorberar lila ljus elektroniska övergångar av högre energier..
Och om materialet absorberar färgen violett, vilken färg kommer den att reflektera? Det kommer att framstå som en gröngul färg, vilket innebär att dess elektroner gör mycket energiska övergångar; medan om materialet absorberar den lägre energiröda färgen, kommer det att återspegla en blågrön färg.
När en atom är mycket stabil uppvisar den i allmänhet mycket avlägsna elektroniska tillstånd i energi; och därför måste du absorbera foton med högre energi för att möjliggöra elektroniska övergångar:
Absorptionsspektrum av molekyler
Molekyler har atomer, och dessa absorberar också elektromagnetisk strålning; deras elektroner är emellertid en del av den kemiska bindningen, så deras övergångar är olika. En av de stora triumferna för den molekylära orbitalteorin är förmågan att relatera absorptionsspektra med den kemiska strukturen.
Således har enkla, dubbla, tredubbla, konjugerade bindningar och aromatiska strukturer sina egna elektroniska tillstånd; och absorberar därför mycket specifika fotoner.
Genom att ha flera atomer, förutom intermolekylära interaktioner, och vibrationerna av deras bindningar (som också absorberar energi), har absorptionsspektren för molekylerna formen av "berg", som indikerar de band som innefattar våglängderna där elektroniska övergångar uppträder.
Tack vare dessa spektra kan en förening karaktäriseras, identifieras och till och med, genom multivariat analys, kvantifieras.
Metylenblå
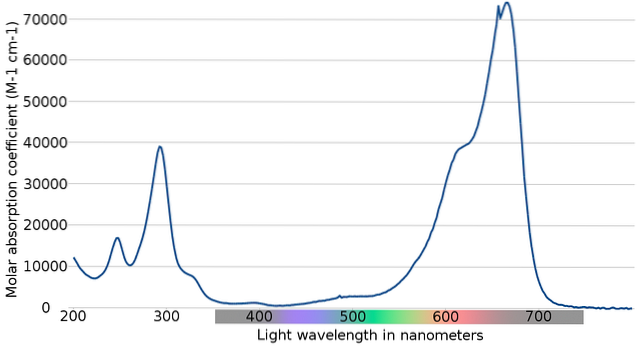
Den övre bilden visar spektrumet för metylenblå indikatorn. Som namnet uppenbarligen antyder är det blått i färg; men kan det verifieras med dess absorptionsspektrum?
Observera att det finns band mellan våglängderna 200 och 300 nm. Mellan 400 och 500 nm finns det nästan ingen absorption, det vill säga den absorberar inte violetta, blåa eller gröna färger.
Den har dock ett starkt absorptionsband efter 600 nm och har därför lågenergiska elektroniska övergångar som absorberar rött ljus fotoner..
Följaktligen, och med tanke på de höga värdena för molära absorptionsförmåga, uppvisar metylenblått en intensiv blå färg..
Klorofyll a och b
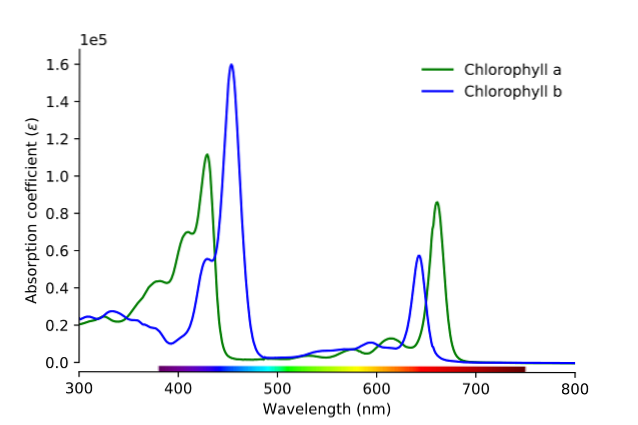
Som framgår av bilden motsvarar den gröna linjen absorptionsspektrumet för klorofyll a, medan den blå linjen motsvarar den för klorofyll b.
Först måste banden där molabsorptionsförmågan är störst jämföras; i detta fall de till vänster, mellan 400 och 500 nm. Klorofyll a absorberar starkt lila färger, medan klorofyll b (blå linje) absorberar blå färger.
Genom att absorbera klorofyll b runt 460 nm reflekteras den blå, den gula färgen. Å andra sidan absorberar den också starkt nära 650 nm, orange ljus, vilket innebär att den uppvisar färgen blå. Om gult och blått blandar sig, vad är resultatet? Färgen grön.
Och slutligen absorberar klorofyll a den blå-violetta färgen och också ett rött ljus nära 660 nm. Därför uppvisar den en grön färg "mjukad" av gul..
Referenser
- Observatoire de Paris. (s.f.). De olika klasserna av spektra. Återställd från: media4.obspm.fr
- Rabanales universitetsområde. (s.f.). Spektrofotometri: Absorptionsspektra och kolorimetrisk kvantifiering av biomolekyler. [PDF]. Återställd från: uco.es
- Day, R., & Underwood, A. (1986). Kvantitativ analytisk kemi (femte upplagan). PEARSON, Prentice Hall, s 461-464.
- Reush W. (s.f.). Synlig och ultraviolett spektroskopi. Återställd från: 2.chemistry.msu.edu
- David Darling. (2016). Absorptionsspektrum. Återställd från: daviddarling.info
- Khan akademin. (2018). Absorptions- / utsläppslinjer. Återställd från: khanacademy.org


Ingen har kommenterat den här artikeln än.