
Natriumnitrat (NaNO3) struktur, egenskaper, användningsområden, risker

De natriumnitrat är ett kristallint oorganiskt fast ämne bildat av en natriumjon Na+ och en nitratjon NO3-. Dess kemiska formel är NaNO3. I naturen finns det som mineralet nitratin eller nitratit, som finns i överflöd i Atacama-öknen i Chile, varför detta mineral också kallas chilensk saltpeter eller caliche.
Natriumnitrat är ett icke-brännbart fast ämne men det kan påskynda oxidationen eller förbränningen av brandfarliga material. Av denna anledning används den i stor utsträckning i fyrverkerier, sprängämnen, tändstickor, kolstenar och vissa typer av bekämpningsmedel för att döda gnagare och andra små däggdjur..

Förmågan att främja förbränning eller antändning av andra material innebär att det måste hanteras med stor försiktighet. Om den utsätts för eld eller eld kan den explodera. Trots detta NaNO3 Det används i livsmedelsindustrin eftersom det har konserverande egenskaper, särskilt för kött och vissa typer av ostar..
Men dess intag i överskott kan orsaka hälsoproblem, särskilt hos gravida kvinnor, spädbarn och barn. Genom att förvandlas till nitrit i matsmältningssystemet kan det orsaka vissa sjukdomar.
Artikelindex
- 1 Kemisk struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 3,7 pH
- 3.8 Övriga egenskaper
- 4 Skaffa
- 4.1 Närvaro i människokroppen
- 5 användningsområden
- 5.1 I livsmedelsindustrin
- 5.2 I gödselmedel
- 5.3 Som en promotor eller facilitator för förbränning eller explosion
- 5.4 För att eliminera gnagare och andra däggdjur
- 5.5 Vid beredning av andra föreningar
- 5.6 Vid utvinning av metaller från elektroniskt avfall
- 5.7 Inom hälso- och träningsforskning
- 5.8 I olika användningsområden
- 6 risker
- 6.1 Faror vid hantering
- 6.2 Problem relaterade till intag av mat eller vatten
- 7 Natriumnitrat i livsmedel
- 8 Referenser
Kemisk struktur
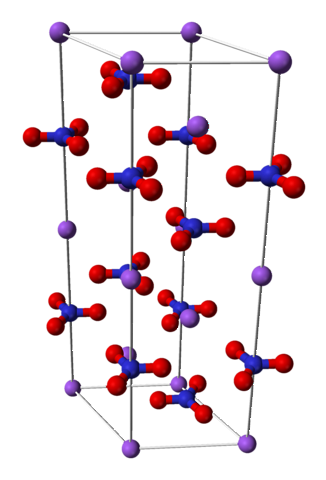
Natriumnitrat består av en natriumkatjon Na+ och en nitratanjon NO3-.
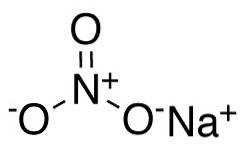
I nitratanjonen NO3- kväve N har en valens av +5 och syre en valens av -2. Av denna anledning har nitratanjonen en negativ laddning..
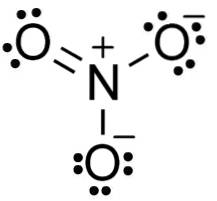
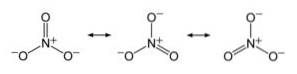
Anion NEJ3- den har en platt och symmetrisk struktur, i vilken de tre oxygene fördelar den negativa laddningen lika eller enhetligt.
Nomenklatur
-Natriumnitrat
-Natriumnitrat
-Sodium saltpeter (från engelska natriumsaltpeter)
-Nitro soda (från engelska soda nitre)
-Saltpeter i Chile
-Nitrat från Chile
-Nitratin
-Nitratit
-Caliche
Egenskaper

Fysiskt tillstånd
Färglösa till vita fasta, trigonala eller rombohedrala kristaller.
Molekylvikt
84,995 g / mol
Smältpunkt
308 ºC
Kokpunkt
380 ºC (sönderdelas).
Densitet
2,257 g / cm3 vid 20 ºC.
Löslighet
Lösligt i vatten: 91,2 g / 100 g vatten vid 25 ºC eller 1 g i 1,1 ml vatten. Något lösligt i etanol och metanol.
pH
Natriumnitratlösningar är neutrala, det vill säga varken sura eller basiska, därför är deras pH 7.
Andra egenskaper
Det är ett hygroskopiskt fast ämne, det vill säga det absorberar vatten från miljön.

Dess upplösning i vatten gör lösningen sval, så det sägs att denna upplösningsprocess är endoterm, med andra ord, när den löser upp absorberar den värme från omgivningen och det är därför lösningen svalnar.
Vid mycket låga temperaturer är natriumnitrat lösligt i NH flytande ammoniak3, bildar NaNO34NH3 under -42 ºC.
Nano3 Det är inte brännbart, men dess närvaro påskyndar förbränningen av material eller föreningar som finns. Detta beror på att det vid uppvärmning producerar syre Otvå, bland andra gaser.
Erhållande
Det erhålls främst genom extraktion från mineralfyndigheter eller saltpetergruvor i Chile (caliche eller nitratit). För detta används saltlösning och sedan utförs kristallisation och omkristallisation för att erhålla NaNO-kristaller.3 renare.
Dessa gruvor finns främst i Sydamerika i norra Chile i Atacama-öknen. Där är det associerat med kaliumnitrat KNO3 och sönderdelande organiskt material.
Det kan också erhållas genom att reagera salpetersyra med natriumkarbonat NatvåCO3 eller med natriumhydroxid NaOH:
2 HNO3 + NatvåCO3 → 2 NaNO3 + COtvå↑ + HtvåELLER
Närvaro i den mänskliga organismen
Natriumnitrat kan komma in i människokroppen genom mat och dricksvatten som innehåller det..
60-80% av intaget nitrat kommer från frukt och grönsaker. En andra källa är härdat kött. Det används av köttindustrin för att förhindra tillväxt av mikrober och för att behålla färg.
En hög andel nitrat som finns i människokroppen kommer dock från dess endogena syntes eller på grund av processer i kroppen..
Applikationer
I livsmedelsindustrin
Det används som konserveringsmedel i livsmedel, som härdningsmedel för inlagat kött och som ett färgretentionsmedel för kött. Mat som kan innehålla det är bacon, korv, skinka och vissa ostar.

I gödselmedel
Natriumnitrat används i gödningsmedelsblandningar för att gödsla tobak, bomull och grönsaksgrödor.

Som en promotor eller promotor för förbränning eller explosion
Nano3 den används som oxidant i många applikationer. Det är ett fast ämne rikt på syre som underlättar antändningsprocessen genom att producera Otvå.
Närvaron av NaNO3 gör att material inte behöver syre från externa källor för att antändas eftersom det ger tillräckligt med Otvå när det gäller självbärande exoterma (värmegenererande) reaktioner som uppstår under antändning eller explosion.
Det har länge använts som den viktigaste oxidanten i pyrotekniska material (fyrverkerier), som en oxiderande komponent i sprängämnen och sprängningsmedel och som drivmedel.

Det används också för att förbättra förbränningen av kolstenar (briketter), för att gynna belysningen i tändstickor och till och med för att förbättra tobaks brännbara egenskaper..
För att eliminera gnagare och andra däggdjur
Det används för en speciell typ av bekämpningsmedel. Kompositionerna som innehåller den är pyrotekniska rökmedel som placeras och tänds i hål och släpper ut dödliga doser av giftiga gaser.
Av den anledningen används den för kontroll av olika gnagare, marmoter, prärievargar och stinkdrycker, i öppna fält, gräsmarker, odlade områden, gräsmattor och golfbanor..
Vid framställning av andra föreningar
Används vid tillverkning av salpetersyra HNO3, natriumnitrit NaNOtvå, och fungerar också som en katalysator vid framställningen av svavelsyra HtvåSW4.
Det används vid tillverkning av dikväveoxid NtvåEller som oxidationsmedel vid tillverkning av farmaceutiska föreningar.
Vid utvinning av metaller från e-avfall
Vissa forskare fann att NaNO3 underlättar icke-förorenande utvinning av metaller som ingår i avfall från elektronisk utrustning (mobiltelefoner, surfplattor, datorer etc.).
Användbara metaller som kan extraheras från komponenterna i denna elektroniska utrustning är Nickel Ni, Cobalt Co, Mangan Mn, Zink Zn, Copper Cu och Aluminium Al.
Extraktionen utförs med endast en NaNO-lösning3 och en polymer. Och ett avkastning på 60% uppnås.
På detta sätt kan elektroniskt avfall återvinnas, vilket bidrar till minimering av avfall och stabil återvinning av resurser..
Inom hälso- och träningsforskning
Enligt vissa studier intag av NaNO-tillskott3 eller livsmedel som innehåller det har naturligt positiva hälsoeffekter. Några av de livsmedel som är rika på nitrater är rödbetor, spenat och rucola.
Effekterna inkluderar att förbättra det kardiovaskulära systemet, sänka blodtrycket, förbättra blodflödet och öka mängden syre i vävnader som tränar fysiskt..
Detta indikerar att användningen av NaNO kan övervägas.3 som ett billigt läkemedel vid förebyggande och behandling av patienter med blodtrycksproblem.
Dessutom kan det fungera som ett effektivt och naturligt hjälpmedel för att öka muskelkraften hos idrottare.
I olika användningsområden

Det används som ett oxidationsmedel och flussmedel vid tillverkning av glas och keramiska glasyrer. Den används också i specialcement.
Fungerar som kemiskt medel vid återvinning av tenn från metallskrot, i latexkoagulering, inom kärnkraftsindustrin och vid kontroll av korrosion i vattenhaltiga system..
Risker
Faror med hantering
Den har egenskapen att påskynda förbränningen av brandfarliga material. Om du är inblandad i en brand kan en explosion inträffa.
När det utsätts för värme eller eld under längre perioder kan det explodera och producera giftiga kväveoxider..
Problem relaterade till dess intag med mat eller vatten
Nitrat vid intag kan bli nitrit både i munnen och i magen och tarmarna..
När nitrit reagerar med aminer som finns i vissa livsmedel kan det bli nitrosaminer i en sur miljö som i magen. Nitrosaminer är cancerframkallande.
Detta inträffar dock inte när frukt och grönsaker som innehåller nitrater äts naturligt..
Enligt vissa studier kan närvaron av höga nivåer av nitrat producera en blodproblem som gör att syre inte kan frigöras effektivt i vävnaderna.
Detta kan inträffa hos spädbarn vars mjölkformel är gjord av brunnvatten som innehåller nitrater..
Det har också observerats att höga nivåer av nitrat kan orsaka problem i dräktigheten hos spädbarn, orsaka spontana aborter, för tidiga födslar eller defekter i fostrets neuralrör..
Nyligen har det visat sig att natriumnitrat kan utgöra en risk för utvecklingen av muskuloskeletala systemet och nerv-muskelkommunikation påverkas hos människor..
Natriumnitrat i livsmedel

Natriumnitrat är synonymt med kött, för tillsammans med nitrit tillsätts de till dem för att bevara dem och förbättra deras utseende och smaker. För sin orsak har överdriven konsumtion av kött (korv, bacon, skinka, rökt fisk etc.) varit inblandad i den störande länken mellan cancer i hela matsmältningssystemet..
Även om förhållandet mellan kött som behandlas med nitrat-nitritsalter och cancer inte är absolut rekommenderas det att moderera ditt intag.
Å andra sidan är grönsaker (morötter, rödbetor, rädisor, sallad, spenat etc.) rika på NaNO3 eftersom de har absorberat det från grödor på grund av dess gödslingsverkan. Intaget av dessa grönsaker, i motsats till köttprodukter, är inte kopplat till de ovannämnda sjukdomarna.
Detta beror på två skäl: skillnaden i proteinnivåerna i sådana livsmedel och sättet de tillagas på. När kött stekas eller värms upp till lågan främjas reaktionen mellan nitrater-nitriter med vissa grupper av aminosyror för att på så sätt producera nitrosoaminer: de verkliga cancerogenerna.
Innehållet av vitamin C, fiber och polyfenoler i grönsaker minskar bildningen av dessa nitrosoaminer. Det är därför NaNO3 ensam är inte ett hot mot maten.
Referenser
- USA National Library of Medicine. (2019). Natriumnitrat. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. och Ravanbod, M. (2015). Kinetisk studie av Mg / NaNO3 pyroteknik med icke-isotermisk TG / DSC-teknik. J Therm Anal Calorim (2015) 119: 2281-2288. Återställd från link.springer.com.
- Jarosz, J. et al. (2016). Natriumnitrat minskar agrininducerat acetylkolinreceptorkluster. BMC Pharmacology and Toxicology (2016) 17:20. Återställd från bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Prival, M.J. (2003). Cancer. Cancerframkallande ämnen i livsmedelskedjan. I Encyclopedia of Food Sciences and Nutrition (andra upplagan). Återställd från sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Komplex extraktion av metaller i ett vattenhaltigt tvåfassystem baserat på poly (etylenoxid) 1500 och natriumnitrat. Molekyler 2019, 24, 4078. Återställd från mdpi.com.
- Clements, W.T. et al. (2014). Förtäring av nitrat: En genomgång av effekterna på hälsa och fysisk prestanda. Näringsämnen 2014, 6, 5224-5264. Återställd från mdpi.com.



Ingen har kommenterat den här artikeln än.