
Metyl eller metylgrupp
De metyl- eller metylgrupp är en alkylsubstituent vars kemiska formel är CH3. Det är det enklaste av alla kolsubstituenter inom organisk kemi, det har ett enda kol och tre väten; härrör från metangas. Eftersom det bara kan binda till ett annat kol, indikerar dess position slutet på en kedja, dess avslutning.
I bilden nedan finns en av de många representationerna för denna grupp. Kurvorna till höger indikerar det bakom H-länken3C- kan vara vilken som helst atom eller substituent; en alkyl, R, aromatisk eller aryl, Ar eller en heteroatom eller funktionell grupp, såsom OH eller Cl.

När den funktionella gruppen som är fäst vid metylen är OH har vi alkoholen metanol, CH3ÅH; och om det är Cl, kommer vi att ha metylklorid, CH3Cl. I den organiska nomenklaturen kallas det helt enkelt "metyl" föregånget av antalet positioner i den längsta kolkedjan..
Metylgruppen CH3 är lätt att identifiera under belysning av organiska strukturer, särskilt tack vare kol 13 kärnmagnetisk resonansspektroskopi (C NMR13). Från det, efter starka oxidationer, erhålls COOH-syragrupper, som är en syntetisk väg för att syntetisera karboxylsyror.
Artikelindex
- 1 Representationer
- 2 Struktur
- 3 fastigheter
- 4 Reaktivitet
- 4.1 Oxidationer
- 4,2 joner
- 4.3 Metyleringsreaktion
- 5 Referenser
Representationer
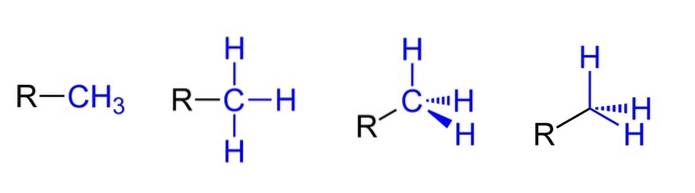
Ovan har vi de fyra möjliga framställningarna förutsatt att CH3 är kopplad till en alkylsubstituent R. Alla är ekvivalenta, men medan de går från vänster till höger är de rumsliga aspekterna av molekylen uppenbara.
Till exempel R-CH3 det ger intrycket att det är platt och linjärt. Representationen som följer visar de tre C-H-kovalenta bindningarna, som gör att metylen kan identifieras i vilken Lewis-struktur som helst och ger ett falskt intryck av att vara ett kors..
Sedan fortsätter du till höger (näst sista), observeras sp-hybridiseringen3 på kolet av CH3 på grund av dess tetraedriska geometri. I den sista framställningen skrivs inte ens den kemiska symbolen för kol, utan tetraedern hålls för att ange vilka H-atomer som är framför eller bakom planet..
Även om det inte finns i bilden, ett annat mycket återkommande sätt när du representerar CH3 den består av att helt enkelt placera bindestrecket (-) "naken". Detta är mycket användbart när du ritar stora kolskelett..
Strukturera

Den översta bilden är den tredimensionella representationen av den första. Den glansiga svarta sfären motsvarar kolatomen, medan de vita är väteatomerna.
Återigen har kol en tetraedrisk miljöprodukt av sin sp-hybridisering3, och som sådan är den en relativt skrymmande grupp, med dess CR-bindningsrotationer steriskt hindrade; det vill säga det kan inte rotera eftersom de vita sfärerna skulle störa de elektroniska molnen i deras närliggande atomer och känna deras avstötning.
C-H-bindningarna kan dock vibrera, precis som C-R-bindningen. Därför CH3 är en grupp av tetraedral geometri som kan belysas (bestämmas, fastställas) med IR-spektroskopi, liksom alla funktionella grupper och kolbindningar med heteroatomer.
Det viktigaste är emellertid dess klargörande med C-NMR.13. Tack vare denna teknik bestäms den relativa mängden metylgrupper, vilket gör det möjligt att montera molekylstrukturen..
I allmänhet ju fler CH-grupper3 ha en molekyl, desto mer "klumpig" eller ineffektiv blir dess intermolekylära interaktioner; ju lägre smält- och kokpunkter kommer att bli. CH-grupper3, på grund av sina väten ”glider” de mot varandra när de närmar sig eller vidrör.
Egenskaper
Metylgruppen kännetecknas av att den är väsentligen hydrofob och apolär.
Detta beror på att deras CH-bindningar inte är särskilt polära på grund av den låga skillnaden mellan elektronegativiteten för kol och väte; Dessutom fördelar dess tetraedriska och symmetriska geometri sina elektrontätheter nästan homogent, vilket bidrar till ett försumbart dipolmoment..
I avsaknad av polaritet, CH3 Den "rinner iväg" från vatten och beter sig som en hydrofob. Därför, om det ses i en molekyl, kommer det att vara känt att denna metylände inte kommer att interagera effektivt med vatten eller annat polärt lösningsmedel..
Ett annat inslag i CH3 är dess relativa stabilitet. Om inte atomen som är bunden till den tar bort sin elektroniska densitet, förblir den praktiskt taget inert mot mycket starka sura medier. Det kommer dock att ses att det kan delta i kemiska reaktioner, främst med avseende på dess oxidation, eller migration (metylering) till en annan molekyl.
Reaktivitet
Oxidationer
CH3 det är inte undantaget från att rosta. Detta innebär att det är känsligt för att bilda bindningar med syre, C-O, om det reagerar med starka oxidationsmedel. När den oxiderar förvandlas den till olika funktionella grupper.
Till exempel ger dess första oxidation upphov till metiol- (eller hydroximetyl) -gruppen, CHtvåOH, en alkohol. Den andra härrör från formylgruppen, CHO (HC = O), en aldehyd. Och den tredje tillåter slutligen dess omvandling till karboxylgruppen, COOH, en karboxylsyra.
Denna serie oxidationer används för att syntetisera bensoesyra (HOOC-C6H5från toluen (H3DC6H5).
Jon
CH3 under mekanismen för vissa reaktioner kan det få momentana elektriska laddningar. Till exempel, när metanol värms upp i ett mycket starkt syramedium, i den teoretiska frånvaron av nukleofiler (sökande av positiva laddningar), metylkatjonen, CH3+, eftersom CH-bandet är trasigt3-OH och OH lämnar med bindningens elektronpar.
Arten CH3+ den är så reaktiv att den endast har bestämts i gasfasen, eftersom den reagerar eller försvinner vid den minsta närvaron av en nukleofil.
Å andra sidan har CH3 en anjon kan också erhållas: metanid, CH3-, den enklaste karbanionen av alla. Men som ch3+, dess närvaro är onormal och förekommer endast under extrema förhållanden.
Metyleringsreaktion
I metyleringsreaktionen överförs en CH3 till en molekyl utan att producera elektriska laddningar (CH3+ inte heller CH3-) i processen. Exempelvis metyljodid, CH3I, är ett bra metyleringsmedel och kan ersätta O-H-bindningen av flera molekyler med en O-CH3.
I organisk syntes innebär detta ingen tragedi; men ja när det som metyleras i överskott är kvävebaserna i DNA.
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Rahul Gladwin. (23 november 2018). Metylering. Encyclopædia Britannica. Återställd från: britannica.com
- Danielle Reid. (2019). Metylgrupp: struktur och formel. Studie. Återställd från: study.com
- Wikipedia. (2019). Metylgrupp. Återställd från: en.wikipedia.org


Ingen har kommenterat den här artikeln än.