
Kvartär struktur av karakteristiska proteiner
De kvartärstruktur av proteiner definierar de rumsliga förhållandena mellan var och en av dess polypeptidsubenheter förenade av icke-kovalenta krafter. I polymera proteiner kallas var och en av de polypeptidkedjor som utgör den subenheter eller protomerer.
Proteiner kan bestå av en (monomer), två (dimer), flera (oligomera) eller många protomerer (polymera). Dessa protomerer kan ha en liknande eller mycket annan molekylär struktur. I det första fallet sägs de vara homotypa proteiner och i det andra fallet heterotypa.
I vetenskaplig notation använder biokemister grekiska bokstäver för att beskriva protomersammansättningen av proteiner. Exempelvis betecknas ett tetrameriskt homotypiskt protein som a4, medan ett tetrameriskt protein som består av två olika dimerer betecknas som atvåβtvå.
Artikelindex
- 1 Proteinstruktur
- 1.1 Primär struktur
- 1.2 Sekundär struktur
- 1.3 Tertiär struktur
- 1.4 Kvartär struktur
- 2 Stabiliteten hos den kvartära strukturen
- 2.1 Hydrofoba interaktioner
- 2.2 Van der Waals-interaktioner
- 2.3 Belastningsinteraktioner
- 2.4 Vätebindningar
- 2.5 Interaktioner mellan dipoler
- 3 Interaktioner mellan protomerer
- 3.1 Homotypiska interaktioner
- 3.2 Heterotypiska interaktioner
- 4 Referenser
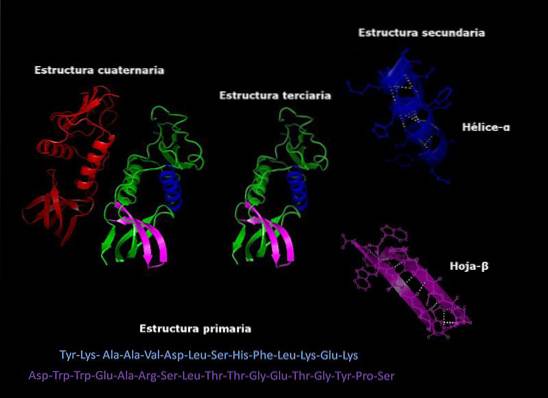
Proteinstruktur
Proteiner är komplexa molekyler som tar olika tredimensionella konfigurationer. Dessa konfigurationer är unika för varje protein och tillåter dem att utföra mycket specifika funktioner. Nivåerna för strukturell organisering av proteiner är som följer.
Primär struktur
Det hänvisar till sekvensen i vilken de olika aminosyrorna är ordnade i polypeptidkedjan. Denna sekvens ges av DNA-sekvensen som kodar för proteinet.
Sekundär struktur
De flesta proteiner är inte helt förlängda långa kedjor av aminosyror, utan har snarare regioner som regelbundet vikas i helixer eller ark. Denna vikning är den som får namnet på den sekundära strukturen.
Tertiär struktur
De vikta områdena i den sekundära strukturen kan i sin tur vikas och monteras till mer kompakta strukturer. Den sista veckningen är det som ger proteinet sin tredimensionella form..
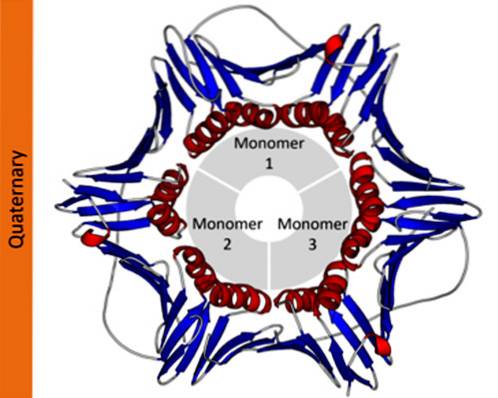
Kvartär struktur
I proteiner som består av mer än en underenhet är de kvartära strukturerna de rumsliga förhållandena som finns mellan varje underenhet, vilka är länkade av icke-kovalenta bindningar..
Kvartär strukturstabilitet
Den tredimensionella strukturen hos proteiner stabiliseras av svaga eller icke-kovalenta interaktioner. Även om dessa bindningar eller interaktioner är mycket svagare än normala kovalenta bindningar, är de många och deras kumulativa effekt är kraftfull. Här kommer vi att se några av de vanligaste interaktionerna.
Hydrofoba interaktioner
Vissa aminosyror innehåller hydrofoba sidokedjor. När proteiner har dessa aminosyror, ordnar vikningen av molekylen dessa sidokedjor mot det inre av proteinet och skyddar dem från vatten. De olika sidokedjornas karaktär innebär att de på olika sätt bidrar till den hydrofoba effekten..
Van der Waals-interaktioner
Dessa interaktioner uppstår när molekyler eller atomer som inte är bundna av kovalenta bindningar kommer för nära varandra och på grund av detta börjar deras yttersta elektroniska orbitaler överlappa varandra..
I det ögonblicket upprättas en motbjudande kraft mellan dessa atomer som växer mycket snabbt när deras respektive centra närmar sig. Dessa är de så kallade "van der Waals styrkorna".
Last-last-interaktioner
Det är den elektrostatiska interaktionen som uppstår mellan ett par laddade partiklar. I proteiner sker denna typ av interaktion, både på grund av den elektriska nettoladdningen för proteinet och den individuella laddningen av jonerna som finns i det. Denna typ av interaktion kallas ibland en saltbro..
Vätebindningar
En vätebindning upprättas mellan en väteatom kovalent bunden till en vätebindningsgivargrupp och ett par fria elektroner som tillhör en bindningsacceptorgrupp.
Denna typ av bindning är mycket viktig, eftersom egenskaperna hos många molekyler, inklusive de hos vatten och biologiska molekyler, till stor del beror på vätebindningar. Den delar egenskaper hos kovalenta bindningar (elektroner delas) och även av icke-kovalenta interaktioner (laddnings-laddningsinteraktion).
Dipolinteraktioner
I molekyler, inklusive proteiner, som inte uppvisar en nettoladdning, kan ett ojämnt arrangemang av deras inre laddningar förekomma, med en extremitet något mer negativ än den andra. Detta är vad som kallas en dipol.
Detta dipolära tillstånd hos molekylen kan vara permanent, men det kan också induceras. Dipoles kan lockas till joner eller andra dipoler. Om dipolerna är permanenta har interaktionen en större omfattning än den som sker med inducerade dipoler.
Förutom dessa icke-kovalenta interaktioner stabiliserar vissa oligomera proteiner sin kvaternära struktur genom en typ av kovalent bindning, disulfidbindningen. Dessa etableras mellan sulfhydrylgrupperna i cysteinerna i olika protomerer.
Disulfidbindningar hjälper också till att stabilisera den sekundära strukturen hos proteiner, men i detta fall länkar de cysteinylrester inom samma polypeptid (intrapolypeptid-disulfidbindningar)..
Interaktioner mellan protomerer
Som nämnts ovan, i proteiner som består av flera underenheter eller protomerer, kan dessa underenheter vara lika (homotypa) eller olika (heterotypa)..
Homotypa interaktioner
De underenheter som utgör ett protein är asymmetriska polypeptidkedjor. Men i homotypa interaktioner kan dessa underenheter associeras på olika sätt och uppnå olika typer av symmetri..
De interagerande grupperna för varje protomer är i allmänhet placerade i olika positioner, varför de kallas heterologa interaktioner. Heterologa interaktioner mellan de olika underenheterna inträffar ibland på ett sådant sätt att varje underenhet vrids i förhållande till den föregående, för att kunna uppnå en spiralformad struktur.
Vid andra tillfällen sker interaktionerna på ett sådant sätt att definierade grupper av underenheter är ordnade runt en eller flera symmetriaxlar, i vad som kallas punktgruppssymmetri. När det finns flera symmetriaxlar roterar varje underenhet med avseende på sin granne 360 ° / n (där n representerar antalet axlar).
Bland de typer av symmetri som erhålls på detta sätt finns till exempel spiralformade, kubiska och ikosahedriska.
När två underenheter interagerar genom en binär axel, roterar varje enhet 180 ° i förhållande till den andra, runt den axeln. Denna symmetri är känd som C-symmetritvå. I den är interaktionsplatserna i varje underenhet identiska; i detta fall talar vi inte om en heterolog interaktion, utan en isolog interaktion.
Tvärtom, sambandet mellan de två komponenterna i dimeren är heterologt, kommer en asymmetrisk dimer att erhållas.
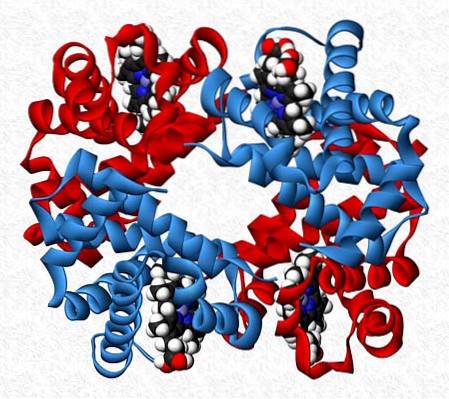
Heterotypiska interaktioner
De interagerande underenheterna i ett protein är inte alltid av samma natur. Det finns proteiner som består av tolv eller flera olika underenheter.
Interaktionerna som bibehåller proteinets stabilitet är desamma som i homotypa interaktioner, men i allmänhet erhålls helt asymmetriska molekyler..
Hemoglobin är till exempel en tetramer som har två par av olika underenheter (αtvåβtvå).
Referenser
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biokemi. 3: e upplagan. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biokemi. 5: e upplagan. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. 2: a upplagan. Thieme.
- A. Lehninger (1978). Biokemi. Ediciones Omega, S.A.
- L. Stryer (1995). Biokemi. W.H. Freeman and Company, New York.



Ingen har kommenterat den här artikeln än.