
Rutherford experimenthistoria, beskrivning och slutsatser
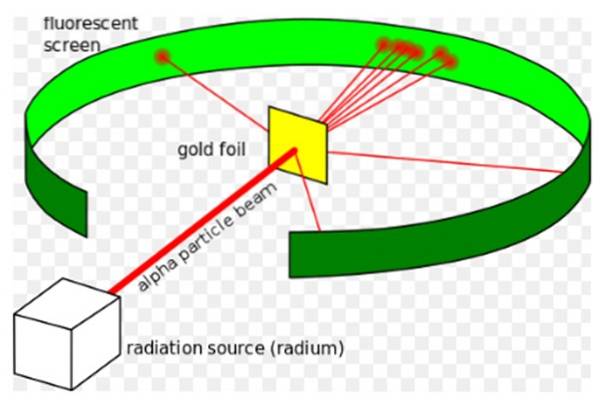
De Rutherford-experiment, utfördes mellan 1908 och 1913, bestod den av att bombardera en tunn guldfolie 0,0004 mm tjock med alfapartiklar och analysera det dispersionsmönster som dessa partiklar lämnade på en fluorescerande skärm.
Faktum är att Rutherford genomförde ett flertal experiment och förfinade detaljerna mer och mer. Efter noggrann analys av resultaten kom två mycket viktiga slutsatser:
-Atomens positiva laddning koncentreras i en region som kallas kärna.
-Denna atomkärna är otroligt liten jämfört med atomens storlek.
Ernest Rutherford (1871-1937) var en Nya Zeeland-född fysiker vars intresseområde var radioaktivitet och materiens natur. Radioaktivitet var ett nytt fenomen när Rutherford började sina experiment, det hade upptäckts av Henri Becquerel 1896.
1907 åkte Rutherford till University of Manchester i England för att studera atomens struktur och använde dessa alfapartiklar som sonder för att kika in i en så liten struktur. Fysikerna Hans Geiger och Ernest Marsden följde honom på uppgiften..
De hoppades att se hur en alfapartikel, som är en dubbelt joniserad heliumatom, skulle samverka med en enda guldatom för att säkerställa att eventuell avvikelse den upplevde enbart berodde på elektrisk kraft..
De flesta alfapartiklar passerade emellertid genom guldfolien med endast en liten avvikelse..
Detta faktum var helt överensstämmande med Thomsons atommodell, men till forskarnas överraskning upplevde en liten andel av alfapartiklarna en ganska anmärkningsvärd avvikelse..
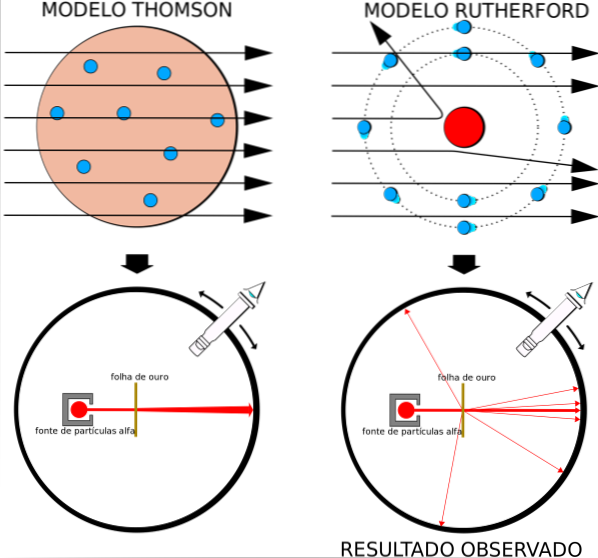
Och en ännu mindre andel partiklar skulle komma tillbaka och studsa helt tillbaka. Vad var dessa oväntade resultat på grund av?
Artikelindex
- 1 Beskrivning och slutsatser av experimentet
- 1.1 Slutsatser
- 2 Påverkan på atommodellen
- 2.1 Nackdelar med Rutherford-modellen
- 2.2 Protonen och neutronen
- 3 Hur är en skalmodell av väteatomen?
- 4 Atommodellen idag
- 5 Referenser
Beskrivning och slutsatser av experimentet
Faktum är att alfapartiklarna som Rutherford använde som sond är heliumkärnor, och vid den tiden var det bara känt att dessa partiklar var positivt laddade. Idag är det känt att alfapartiklar består av två protoner och två neutroner..
Alfapartiklar och betapartiklar hade identifierats av Rutherford som två olika typer av strålning från uran. Alfapartiklar, mycket mer massiva än elektronen, har en positiv elektrisk laddning, medan betapartiklar kan vara elektroner eller positroner..
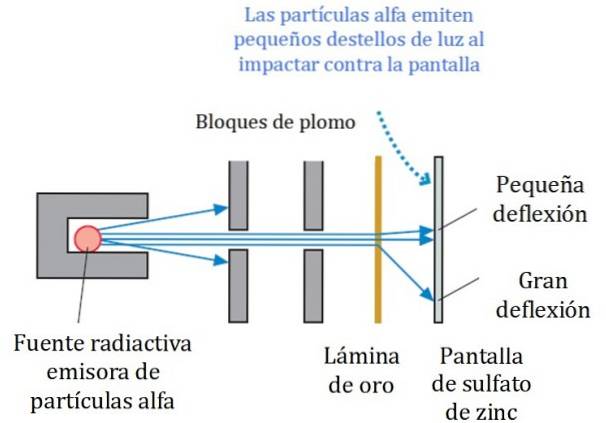
Ett förenklat schema för experimentet visas i figur 2. Alfa-partikelstrålen kommer från en radioaktiv källa. Geiger och Marsden använde radongas som sändare.
Blyblocken användes för att rikta strålningen mot guldfolien och förhindra att den går direkt till den fluorescerande skärmen. Bly är ett material som absorberar strålning.
Den så riktade strålen fick sedan träffa en tunn guldfolie och de flesta av partiklarna fortsatte på väg till zinksulfats fluorescerande skärm, där de lämnade ett litet ljusspår. Geiger var ansvarig för att räkna dem en efter en, även om de senare designade en enhet som gjorde det.
Det faktum att vissa partiklar genomgick en liten avböjning överraskade inte Rutherford, Geiger och Marsden. När allt kommer omkring finns det positiva och negativa laddningar på atomen som utövar krafter på alfapartiklarna, men eftersom atomen är neutral, vilket de redan visste, måste avvikelserna vara små..
Experimentets överraskning är att några positiva partiklar studsades nästan direkt tillbaka..
Slutsatser
Cirka 1 av 8000 alfapartiklar avböjdes i vinklar större än 90 °. Få, men tillräckligt för att ifrågasätta vissa saker.
Atommodellen på modet var den för russinpudding av Thomson, Rutherfords tidigare professor vid Cavendish Laboratory, men Rutherford undrade om idén om en atom utan kärna och med elektroner inbäddade som russin, var korrekt..
Eftersom det visar sig att dessa stora avböjningar av alfapartiklar, och det faktum att ett fåtal kan återvända, kan bara förklaras om en atom har en liten, tung, positiv kärna. Rutherford antog att endast de elektriska attraktiva och motbjudande krafterna, som indikeras av Coulombs lag, var ansvariga för eventuell avvikelse..
När några av alfapartiklarna närmar sig direkt mot denna kärna och eftersom den elektriska kraften varierar med avståndets inversa kvadrat, känner de en avstötning som orsakar dem vidvinkelspridning eller bakåtböjning..
För att vara säker experimenterade Geiger och Marsden med att bombardera ark av olika metaller, inte bara guld, även om denna metall var den mest lämpliga för sin smidighet, för att skapa mycket tunna ark..
Genom att erhålla liknande resultat var Rutherford övertygad om att den positiva laddningen i atomen skulle placeras i kärnan och inte spridas över dess volym, som Thomson antydde i sin modell..
Å andra sidan, eftersom den stora majoriteten av alfapartiklar passerade utan avvikelse, måste kärnan vara mycket, mycket liten jämfört med atomstorleken. Men denna kärna var tvungen att koncentrera större delen av atommassan.
Påverkan på atommodellen
Resultaten förvånade Rutherford, som förklarade vid en konferens i Cambridge: ”... Det är som när du avfyrar en 15-tums kanonkula mot ett ark mjukpapper och projektilen studsar rakt mot dig och träffar dig.".
Eftersom dessa resultat inte kunde förklaras av Thomsons atommodell, föreslog Rutherford att atomen bestod av en kärna, mycket liten, mycket massiv och positivt laddad. Elektronerna förblev i banor runt honom, som ett miniatyr solsystem.
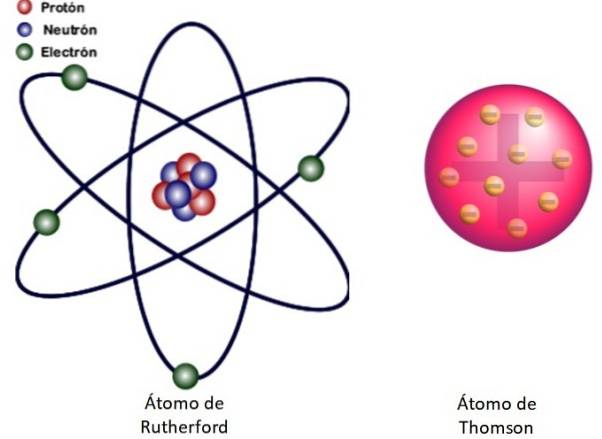
Detta är vad kärnmodellen för atomen som visas i figur 3 till vänster handlar om. Eftersom elektronerna är mycket, mycket små också, visar det sig att atomen är nästan allt ... tömma! Därför passerar de flesta alfapartiklar genom arket som avböjs knappt..
Och analogin med ett miniatyr solsystem är mycket exakt. Atomkärnan spelar rollen som solen och innehåller nästan all massa plus den positiva laddningen. Elektroner kretsar kring dem som planeter och bär en negativ laddning. Enheten är elektriskt neutral.
Om distributionen av elektroner i atomen visade Rutherfords experiment inget. Du kanske tror att alfapartiklarna skulle ha en viss interaktion med dem, men elektronernas massa är för liten och de kunde inte avleda partiklarna markant..
Nackdelar med Rutherford-modellen
Ett problem med denna atommodell var just elektronernas beteende.
Om dessa inte var statiska, utan kretsar kring atomkärnan i cirkulära eller elliptiska banor, styrda av elektrisk attraktion, skulle de hamna mot kärnan..
Detta beror på att de accelererade elektronerna tappar energi, och om det händer skulle det vara atomens och materiens kollaps..
Lyckligtvis är det inte detta som händer. Det finns en slags dynamisk stabilitet som förhindrar kollaps. Nästa atommodell, efter Rutherfords, var Bohrs, som gav några svar på varför atomkollaps inte inträffar.
Protonen och neutronen
Rutherford fortsatte att göra spridningsexperiment. Mellan 1917 och 1918 valde han och hans assistent William Kay att bombardera gasformiga kväveatomer med de mycket energiska alfapartiklarna från vismut-214..
Han blev förvånad igen när han upptäckte vätekärnor. Detta är reaktionens ekvation, den första konstgjorda kärntransmutationen som någonsin uppnåtts:
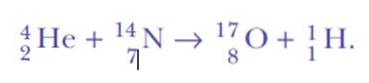
Svaret var: från samma kväve. Rutherford hade tilldelat väte atomnummer 1, eftersom det är det enklaste elementet av alla: en positiv kärna och en negativ elektron.
Rutherford hade hittat en grundläggande partikel som han kallade proton, ett namn som härstammar från det grekiska ordet för Först. På detta sätt är protonen en väsentlig beståndsdel i varje atomkärna..
Senare, omkring 1920, föreslog Rutherford att det måste finnas en neutral partikel med en massa som mycket liknar den hos protonen. Han kallade denna partikel neutron och det är en del av nästan alla kända atomer. Fysikern James Chadwick identifierade det äntligen 1932.
Hur är en skalmodell av väteatomen?
Väteatomen är, som vi har sagt, den enklaste av alla. Det var dock inte lätt att utveckla en modell för denna atom..
Efterföljande upptäckter gav upphov till kvantfysik och en hel teori som beskriver fenomen i atomskala. Under denna process utvecklades också atommodellen. Men låt oss ta en titt på frågan om storlekar:
Väteatomen har en kärna som består av en proton (positiv) och har en enda elektron (negativ).
Väteatomens radie har uppskattats till 2,1 x 10-10 m, medan protonens är 0,85 x 10 -femton m eller 0,85 femtometrar. Namnet på den här lilla enheten beror på Enrico Fermi och används mycket när man arbetar i denna skala.
Tja, kvoten mellan atomens radie och kärnans radie är i storleksordningen 105 m, det vill säga, atomen är 100 000 gånger större än kärnan!!.
Det måste dock tas med i beräkningen att i samtida modell, baserad på kvantmekanik, omsluter elektronen kärnan i ett slags moln som kallas orbital (en bana är inte en omloppsbana) och elektronen, i atomskala, är inte punktlig.
Om väteatomen förstorades - fantasifullt - till storleken på ett fotbollsplan, så skulle kärnan bestående av ett positivt proton vara storleken på en myra i fältets mitt, medan den negativa elektronen skulle vara som ett slags spöke , spridda över hela fältet och omger den positiva kärnan.
Atommodellen idag
Denna "planetära" atommodell är väldigt ingrodd och är den bild som de flesta har av atomen, eftersom den är mycket lätt att visualisera. i alla fall, Det är det inte den modell som accepteras idag inom det vetenskapliga området.
Samtida atommodeller är baserade på kvantmekanik. Hon påpekar att elektronen i atomen inte är en negativt laddad punkt som följer exakta banor, som de Rutherford föreställde sig..
Snarare är elektronen det spridd i zoner, runt den positiva kärnan, kallas atomorbitaler. Från honom kan vi veta sannolikhet att vara i ett eller annat tillstånd.
Trots detta representerade Rutherfords modell ett enormt framsteg i förståelsen av atomens inre struktur. Och det banade väg för fler forskare att fortsätta att förfina det..
Referenser
- Andriessen, M. 2001. HSC-kurs. Fysik 2. Jacaranda HSC Science.
- Arfken, G. 1984. Universitetsfysik. Academic Press.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Fysik OpenLab. Rutherford-Geiger-Marsden-experimentet. Återställd från: physicsopenlab.org.
- Rex, A. 2011. Grundläggande fysik. Pearson.
- Tyson, T. 2013. Rutherford Scattering Experiment. Hämtad från: 122.physics.ucdavis.edu.
- Xaktly. Rutherfords experiment. Återställd från: xaktly.com.
- Wikipedia. Rutherfords experiment. Återställd från: es.wikipedia.org.



Ingen har kommenterat den här artikeln än.