
Kompressibilitetsfaktor hur man beräknar, exempel och övningar
De kompressibilitetsfaktor Z, eller kompressionsfaktor för gaser, är ett dimensionslöst värde (utan enheter) som införs som en korrigering i tillståndsekvationen för idealgaser. På detta sätt liknar den matematiska modellen närmare gasens observerade beteende..
I den ideala gasen är tillståndsekvationen som hänför sig till variablerna P (tryck), V (volym) och T (temperatur): P.V idealisk = n.R.T med n = antal mol och R = idealgaskonstant. Genom att lägga till korrigeringen för kompressibilitetsfaktorn Z blir denna ekvation:
P.V = Z.n.R.T
Artikelindex
- 1 Hur man beräknar kompressibilitetsfaktor?
- 2 Exempel
- 2.1 Kompressibilitetsfaktorn i ideala gaser, luft, väte och vatten
- 3 Lösta övningar
- 3.1 Övning 1
- 3.2 Övning 2
- 4 Referenser
Hur man beräknar kompressibilitetsfaktor?
Med hänsyn till att molvolymen är VHäftigt = V / n, vi har den verkliga molära volymen:
P . Vverklig = Z. R. T → Z = PV verklig/ RT
Eftersom kompressibilitetsfaktorn Z beror på gasförhållandena uttrycks den som en funktion av tryck och temperatur:
Z = Z (P, T)
Jämförelse av de två första ekvationerna kan man se att om antalet mol n är lika med 1, är molvolymen för en verklig gas relaterad till den för idealgas genom:
Vverklig / Videalisk = Z → V verklig = Z Videalisk
När trycket överstiger 3 atmosfärer slutar de flesta av gaserna att fungera som ideala gaser och den verkliga volymen skiljer sig avsevärt från idealet.
Detta förverkligades i hans experiment av den holländska fysikern Johannes Van der Waals (1837-1923), som ledde honom till att skapa en modell som passade bättre för praktiska resultat än den ideala gasekvationen: Van-ekvationen av staten..
Exempel
Enligt ekvationen P.Vverklig= Z.n.RT, För en idealgas är Z = 1. Men i riktiga gaser, när trycket ökar, ökar värdet på Z. med den volymen.
Å andra sidan, vid lägre tryck, rör sig molekylerna mer fritt och de avstötande krafterna minskar. Därför förväntas en lägre volym. När det gäller temperaturen minskar Z när den ökar.
Som Van der Waals observerade, i närheten av den så kallade kritiska punkten, avviker gasens beteende kraftigt från en idealgas..
Den kritiska punkten (Tc, Pc) för något ämne är de tryck- och temperaturvärden som bestämmer dess beteende före en fasändring:
-Tc är temperaturen över vilken gasen i fråga inte flytande.
-Pc är det minsta tryck som krävs för att kondensera gasen vid temperaturen Tc
Varje gas har sin egen kritiska punkt, men definierar temperaturen och det reducerade trycket Tr Och sr som följer:
Pr = P / Pc
Vr = V / Vc
Tr = T / Tc
Det observeras att en begränsad gas med identisk Vr Y Tr utövar samma tryck Pr. Av denna anledning, om Z ritas som en funktion av Pr till sig själv Tr, varje punkt på den kurvan är densamma för varje gas. Det här kallas principen för motsvarande stater.
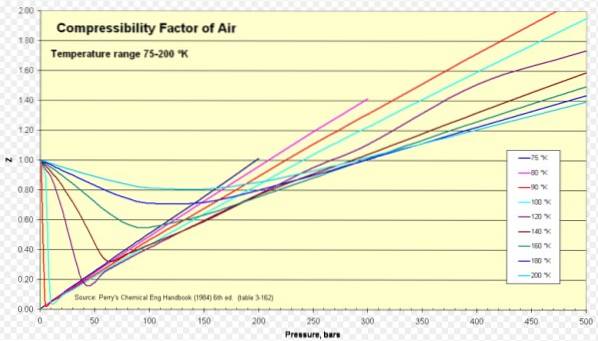
Kompressibilitetsfaktorn i ideala gaser, luft, väte och vatten
Nedan är en kompressibilitetskurva för olika gaser vid olika reducerade temperaturer. Här är några exempel på Z för vissa gaser och en procedur för att hitta Z med kurvan.
Ideala gaser
Ideala gaser har Z = 1, vilket förklarades i början.
Luft
För luft är Z ungefär 1 inom ett brett spektrum av temperaturer och tryck (se figur 1), där den ideala gasmodellen ger mycket bra resultat.
Väte
Z> 1 för alla tryck.
Vatten
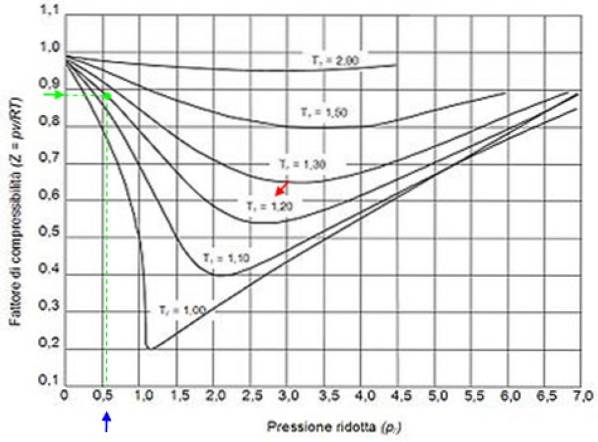
För att hitta Z för vatten behöver du de kritiska punktvärdena. Vattnets kritiska punkt är: Pc = 22,09 MPa och Tc= 374,14 ° C (647,3 K). Återigen måste man ta hänsyn till att kompressibilitetsfaktorn Z beror på temperatur och tryck..
Antag till exempel att du vill hitta Z-vatten vid 500 ºC och 12 MPa. Då är det första att göra att beräkna den reducerade temperaturen, för vilken grader Celsius måste omvandlas till Kelvin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
Med dessa värden placerar vi kurvan som motsvarar T i diagrammetr = 1.2, indikerad med en röd pil. Därefter letar vi efter värdet på P på den horisontella axelnr närmare 0,54, markerade i blått. Nu ritar vi en vertikal tills vi fångar upp kurvan Tr = 1.2 och slutligen projiceras den från den punkten till den vertikala axeln, där vi läser det ungefärliga värdet på Z = 0,89.
Lösta övningar
Övning 1
Det finns ett gasprov vid en temperatur på 350 K och ett tryck på 12 atmosfärer, med en molär volym som är 12% större än vad som förutspås av den ideala gaslagen. Beräkna:
a) Kompressionsfaktor Z.
b) Molvolym gas.
c) Enligt de tidigare resultaten, ange vilka som är de dominerande krafterna i detta gasprov.
Data: R = 0,082 L.atm / mol.K
Lösning till
Att veta att V verklig är 12% större än Videalisk :
Vverklig = 1,12Videalisk
Z = V verklig / Videalisk = 1,12
Lösning b
P. Vverklig = Z. R. T → Vverklig = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Lösning c
De avstötande krafterna är de som dominerar, eftersom provets volym ökade.
Övning 2
Det finns 10 mol etan begränsat i en volym av 4,86 l vid 27 ºC. Hitta trycket från etan från:
a) Den ideala gasmodellen
b) Van der Waals-ekvationen
c) Hitta komprimeringsfaktorn från tidigare resultat.
Data för etan
Van der Waals-koefficienter:
a = 5 489 dm6. bankomat. mol-två och b = 0,06380 dm3. mol-1.
Kritiskt tryck: 49 atm. Kritisk temperatur: 305 K
Lösning till
Temperaturen överförs till kelvin: 27 º C = 27 +273 K = 300 K, kom också ihåg att 1 liter = 1 L = 1 dm3.
Därefter ersätts de levererade uppgifterna till den ideala gasekvationen:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Lösning b
Van der Waals tillståndsekvation är:
Där a och b är de koefficienter som anges i uttalandet. När du rensar P:
Lösning c
Vi beräknar reducerat tryck och temperatur:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Med dessa värden letar vi efter värdet av Z i diagrammet i figur 2 och finner att Z är ungefär 0,7.
Referenser
- Atkins, P. 1999. Fysisk kemi. Omega-utgåvor.
- Cengel, Y. 2012. Termodynamik. 7mamma Utgåva. Mcgraw hill.
- Engel, T. 2007. Introduktion till fysikalisk kemi: termodynamik. Pearson.
- Levine, I. 2014. Principer för fysikalisk-kemi. 6: e. Utgåva. Mcgraw hill.
- Wikipedia. Kompressibilitetsfaktor. Återställd från: en.wikipedia.org.


Ingen har kommenterat den här artikeln än.