
Nickel (III) hydroxidstruktur, egenskaper, användningsområden, risker

De nickel (III) hydroxid Det är en oorganisk förening där nickelmetall har ett oxidationsnummer på 3+. Dess kemiska formel är Ni (OH)3. Enligt källorna som konsulterats har det hittills inte varit möjligt att verifiera förekomsten av nickel (III) hydroxid Ni (OH)3, men det har varit möjligt att erhålla nickel (III) oxo-hydroxid, NiO (OH).
Nickel (III) oxohydroxid NiO (OH) är ett svart kristallint fast ämne som kristalliserar i två former: beta- och gammaformerna. Den vanligaste kristallina formen av NiO (OH) är beta.
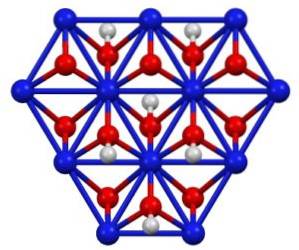
NiO (OH) kan erhållas genom oxidation av nickel (II) nitratlösningar (Ni (NO3)tvåmed klor (Cltvå) eller brom (Brtvåi närvaro av kaliumhydroxid (KOH). Nickel (III) oxohydroxid är mycket lösligt i syror. Den kan appliceras i nickelbatterier, i superkondensatorer och som en regenererbar katalysator.
Nickel (III) oxo-hydroxid NiO (OH) och nickel (II) hydroxid Ni (OH)två är förenade i driften av de flesta av sina applikationer, eftersom båda är en del av samma oxidreduktionsekvation.
Att vara en nickelförening, NiO (OH) innebär samma risker som andra nickelsalter, det vill säga hudirritation eller dermatit och cancer.
Artikelindex
- 1 Kristallstruktur
- 2 Elektronisk konfiguration
- 3 Nomenklatur
- 4 fastigheter
- 4.1 Fysiskt tillstånd
- 4.2 Löslighet
- 4.3 Övriga egenskaper
- 5 användningsområden
- 5.1 I nickelbatterier
- 5.2 Vid elektrokatalys som en regenererbar katalysator
- 5.3 I superkondensatorer
- 5.4 Vid oxidation av metalljoner
- 6 risker
- 7 Referenser
Kristallstruktur
Nickel (III) oxohydroxid kristalliserar i två former: beta och gamma. Betaformen β-NiO (OH) har en mycket liknande struktur som β-Ni (OH)två, vilket verkar logiskt eftersom det förstnämnda kommer från oxidationen av det senare.
Gamma-y-NiO (OH) -formen är oxidationsprodukten av nickel (II) hydroxid i sin alfa-form, a-Ni (OH)två. Liksom den senare har gamma en skiktad struktur med alkalimetalljoner, anjoner och vatten som är isär mellan skikten..
Elektronisk konfiguration
I NiO (OH) är nickel i oxidationsläget 3+, vilket innebär att dess yttersta lager saknar 3 elektroner, det vill säga två elektroner saknas i lager 4s och en elektron från skal 3d. Elektronkonfigurationen för Ni3+ i NiO (OH) är det: [Ar] 3d7, där [Ar] är elektronkonfigurationen för ädelgasargonen.
Nomenklatur
- NiO (OH): Nickel (III) oxohydroxid
- Nickelsvart
Egenskaper
Fysiskt tillstånd
Svart kristallint fast ämne.
Löslighet
NiO (OH) oxohydroxid är mycket lösligt i syror. Gamma-fasen löser sig i svavelsyra med syreutveckling.
Andra egenskaper
I varmt vatten blir det nickel (II) och (III) oxohydroxid, Ni3ELLERtvå(ÅH)4.
Den sönderdelas vid 140 ° C i nickel (II) oxid (NiO), vatten och syre.
Gamma-fasen (y-NiO (OH)) kan erhållas på olika sätt, exempelvis genom att behandla nickel med en smält blandning av natriumperoxid (Na2).tvåELLERtvå) och natriumhydroxid (NaOH) vid 600 ° C och kylning i isvatten.
Gamma-fasen sönderdelas vid uppvärmning till 138 ºC.
Applikationer
I nickelbatterier
Edisons nickeljärnbatteri, där KOH används som elektrolyt, är baserat på reaktionen mellan nickel (III) oxohydroxid och järn:
Ladda ner:
Fe + 2NiO (OH) + HtvåO ⇔ Fe (OH)två + 2Ni (OH)två
Ladda:
Det är en reversibel oxidationsreduktionsreaktion.
En serie kemiska och elektrokemiska processer äger rum vid anoden på dessa batterier. Här är en allmän översikt:
Ladda ner
β-Ni (OH)två ⇔ β-NiO (OH) + H+ + och-
Ladda
Åldrande ↑ ↓ Överbelastning
Ladda ner
a-Ni (OH)två Y-NiO (OH) + H+ + och-
Ladda
I nickelbatteriteknik kallas nickel (III) oxohydroxid NiO (OH) för "aktiv nickelmassa".

Vid elektrokatalys som en regenererbar katalysator
NiO (OH) har använts framgångsrikt vid elektrosyntesen av azopyrazoler genom elektrokatalytisk oxidation av aminopyrazoler. Dess användbarhet vid syntes av karboxylsyror med utgångspunkt från alkoholer eller karbonylföreningar har också bevisats..

Ett annat exempel är den kvantitativa omvandlingen av hydroximetylpyridin till en pyridinkarboxylsyra. I detta fall täcks stål- eller nickelektroden som motsvarar anoden med ett lager av NiO (OH). Mediet i vilket elektrolysen utförs är alkaliskt.
I dessa reaktioner fungerar NiO (OH) som en reduktionsoxidationsmediator eller "redox" -mediator..
Elektrolysen utförs i en cell med nickelanod och titankatod, i ett alkaliskt medium. Ni (OH) bildas under processentvå på ytan av nickelanoden, som snabbt oxideras till NiO (OH):
Ni (OH)två + Åh- - och- Ni Ni (OH) + HtvåELLER
NiO (OH) reagerar med det organiska substratet och den önskade organiska produkten erhålls och regenererar Ni (OH)två:
NiO (OH) + organisk förening → Ni (OH)två + produkt
När Ni (OH) regenererartvå, katalysreaktionen fortsätter.
Användningen av NiO (OH) som elektrokatalysator gör det möjligt att erhålla organiska föreningar till låga kostnader och på ett miljövänligt sätt.
I superkondensatorer
NiO (OH) tillsammans med Ni (OH)två gör utmärkta material för superkondensatorelektroder. superkondensatorer).
Ni (OH)två + Åh- Ni Ni (OH) + HtvåO + e-
De har hög kapacitet, låga kostnader och enligt vissa referenser låg miljöpåverkan.

De har dock låg ledningsförmåga. Detta löses genom att använda nanopartiklar av nämnda föreningar, eftersom detta ökar ytarean och minskar det avstånd som krävs för diffusion, vilket säkerställer en hög hastighet för överföring av elektroner och / eller joner..
Vid oxidation av metalljoner
En av de kommersiella tillämpningarna av nickel (III) oxohydroxid är baserad på dess förmåga att oxidera kobolt (II) joner i lösning till kobolt (III) joner..
Risker
Nickel i lösning är mer stabil som Ni-jontvå+, därför är det inte vanligt att komma i kontakt med Ni-lösningar3+. Försiktighetsåtgärderna är emellertid desamma, eftersom nickel, oavsett om det är metalliskt, i lösning eller i form av dess fasta salter, kan orsaka hudsensibilisering..
Det är lämpligt att använda skyddsutrustning och kläder, t.ex. ansiktsskydd, handskar och skyddsskor. Allt detta måste användas när det finns möjlighet att komma i kontakt med nickellösningar..
Om dermatit uppstår, bör det behandlas med en läkare för att utesluta att det orsakas av nickel..
När det gäller möjligheten till inandning är det bra praxis att hålla koncentrationerna av nickelsaltsdamm i luften mycket låga med lokal ventilation och använda andningsskydd vid behov..
Alla nickelföreningar klassificeras av International Agency for Research on Cancer, eller IARC. Internationella byrån för cancerforskning), i kategorin cancerframkallande för människor.
Detta är baserat på epidemiologiska och experimentella data.
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Lyalin, B.V. et al. Elektrosyntes av azopyrazoler via oxidation av N-alkylaminopyrazoler på en NiO (OH) anod i vattenhaltig alkali - En grön metod för N-N-homokoppling. Tetrahedron Letters. 59 (2018) 2741-2744. Återställd från sciencedirect.com.
- Liuyang, Zhang, et al. (2018). Nickelbaserade material för superkondensatorer. Material idag. Återställd från sciencedirect.com
- Ettel, V.A. och Mosolu, M. A. (1977). Beredning av Nickel Black. USA Patent nr 4 006 216. 1 februari 1977.
- Scharbert, B. (1993). Förfarande för oxidering av hydroximetylpyridinderivat till pyridinkarboxylsyraderivat vid nickeloxidhydroxidanoder. USA Patent nr 5,259,933. 9 november 1993.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volym 17. Fjärde upplagan. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Nickelhydroxider. I Handbok för batterimaterial. VCH-utgivare. Återställd från osti.gov.



Ingen har kommenterat den här artikeln än.