
Kaliumfosfat (K3PO4) struktur, egenskaper, användningsområden
De Kaliumfosfat är en oorganisk förening bildad av tre kalium K-joner+ och en fosfatjon PO43-. Dess kemiska formel är K3PO4. Det är ett färglöst eller vitt kristallint fast ämne. Det är mycket lösligt i vatten och bildar alkaliska lösningar, det vill säga med många OH-joner-, därav grundläggande pH.
Fosfatjonen har en viktig funktion i celler som har att göra med energilagring. Kaliumfosfat används ofta i organiska kemireaktioner där det kan fungera som en bas, det vill säga ta H-protoner+. Det kan också fungera som en katalysator eller accelerator för vissa reaktioner.

Det har använts för att minska angrepp av vissa insekter på veteplanter eftersom det gör dem mer motståndskraftiga mot dessa. Det har emellertid observerats att det gynnar utvecklingen av metan (CH4), en växthusgas, från rismikrokulturer.
Det har använts som laxermedel, för att öka varaktigheten av lokalbedövning, för att stoppa håligheter och för att underlätta ytor, bland andra applikationer.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 3,6 pH
- 3.7 Kemiska egenskaper
- 3.8 Övriga egenskaper
- 3.9 Fosfatets roll i människokroppen
- 4 Skaffa
- 5 användningsområden
- 5.1 Som grund i organiska kemiska reaktioner
- 5.2 Som katalysator
- 5.3 Inom jordbruket
- 5.4 I medicinska tillämpningar
- 5.5 Som laxermedel
- 5.6 Inom veterinärmedicin
- 5.7 Att erhålla DNA
- 5.8 I olika applikationer
- 5.9 Negativ aspekt för användning inom jordbruket
- 6 Referenser
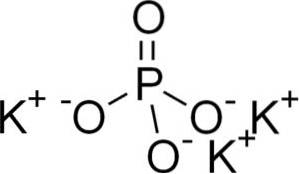
Strukturera
Kaliumfosfat består av tre kalium K-katjoner+ och en fosfatanjon PO43-.
Fosfatjonen PO43- Den består av en fosforatom (P) och fyra syreatomer (O), där fosfor har ett oxidationstillstånd på +5 och oxygener en valens på -2.
Nomenklatur
- Kaliumfosfat
- Tripotiumfosfat
- Tribasiskt kaliumfosfat
- Trekaliumortofosfat
Egenskaper
Fysiskt tillstånd
Färglös eller vit kristallin fast substans.
Molekylvikt
212,27 g / mol
Smältpunkt
1340 ºC
Densitet
2,564 g / cm3
Löslighet
Mycket löslig i vatten: 106 g / 100 g vatten vid 25 ° C. Olöslig i etanol.
pH
En lösning med 1% K3PO4 har ett pH av 11,5-12,3.
Kemiska egenskaper
När det är löst i vatten separeras kaliumfosfat i de tre kalium-K-katjonerna.+ och fosfatanjonen PO43-. Fosfatanjonen tar en proton från vattnet och vätefosfatanjonen HPO bildas4två-. Den senare tar i sin tur ytterligare en proton från vattnet och blir dihydrogenfosfatanjonen HtvåPO4-.
PO43- + HtvåO ⇔ HPO4två- + Åh-
HPO4två- + HtvåO ⇔ HtvåPO4- + Åh-
När OH-joner bildas- vattenlösning blir alkalisk.
Andra egenskaper
Förutom den vattenfria formen (utan vatten) har den flera hydratiserade former; detta betyder att K-molekylen3PO4 kan åtföljas av en eller flera vattenmolekyler inom den kristallina strukturen.
Av denna anledning kan den till exempel bilda monohydratet K3PO4.HtvåEller trihydrat K3PO4.3HtvåEller heptahydrat och nonahydrat.
Fosfatets roll i människokroppen
Fosfatjonen PO43- det är den vanligaste anjonen i cellerna och spelar en viktig roll i energilagring.
Fosfatjonen deltar också i bildandet och näringsaktiviteterna av ben och tänder, eftersom det reglerar koncentrationen av kalcium i blodserumet och i många energiöverföringsreaktioner i cellen..
Erhållande
Kaliumfosfat kan erhållas med början från reaktionen mellan kaliumklorid KCl och ammoniumfosfat (NH4)3PO4.
Kaliumklorid + ammoniumfosfat → Kaliumfosfat + ammoniumklorid
3 KCl + (NH4)3PO4 → K3PO4 + 3 NH4Cl
Applikationer
Som grund i organiska kemiska reaktioner
Kalium K-fosfat3PO4 Det har använts i olika organiska kemiska reaktioner. Till exempel tjänar den till syntesen av acetylener utgående från dibromerade föreningar..
I denna syntes inträffar en dehydrobrominering (eliminering av väte och brom), där K3PO4 vattenfritt fast ämne (utan vatten) fungerar som en mjuk bas och tar två protoner från molekylen, de två bromatomerna avlägsnas och motsvarande acetylen erhålls.
C6H5-CHBr-CHtvåBr + 2 K3PO4 → C6H5-C≡CH + 2 KBr + 2 KtvåHPO4

Som katalysator
K: t3PO4 fungerar som en katalysator i olika organiska kemiska reaktioner. Till exempel har den använts som ett fast ämne för att erhålla biodiesel från använd stekolja..
Biodiesel är ett bränsle som liknar diesel men erhålls från fetter eller naturliga oljor som används eller inte.
Kaliumfosfat var effektivare som en katalysator eller accelerator för denna reaktion än natriumfosfat Na3PO4 och kalciumoxid CaO.
Inom jordbruket
K: t3PO4 har använts för att behandla veteväxter och göra dem resistenta mot vissa skadedjur.

Vissa forskare behandlade veteplantor med kaliumfosfat och det visade sig att det inducerar resistens mot bladlus. Diuraphis noxia, en insekt som attackerar dessa växter.
Efter applicering av en utspädd lösning av K3PO4 mindre svårighetsgrad av symtomen orsakade av dessa insekter och en minskning av antalet bladlöss som matas på dem observerades på plantorna.

I medicinska applikationer
Kaliumfosfat har använts för att modifiera bedövningseffekten av lidokain, en lokalbedövning. En lokalbedövning är ett läkemedel som när det appliceras på ett område av kroppen orsakar förlust av känslighet för smärta i det området..
Det konstaterades att K3PO4 gör det möjligt att förlänga lokalbedövningen av lidokain.
Som laxermedel
Kaliumfosfat ökar tarminnehållets flytbarhet eftersom det hjälper till att hålla kvar vatten i tarmen, vilket indirekt inducerar sammandragningen av tarmmuskeln.
Inom veterinärmedicin
K: t3PO4 används till djur med diabetisk ketoacidos (en komplikation av diabetes) för att behandla hypofosfatemi (låg mängd fosfat i blodet).
Men när det ges i överskott kan det orsaka hypokalcemi (lågt kalcium i blodet), hyperfosfatemi (överskott av fosfat i blodet), ofrivillig sammandragning av muskler, mineralisering av mjukvävnader och njursvikt..
Vid erhållande av DNA
Kaliumfosfat har använts som buffert för att rena DNA i genetiklaboratorier.
DNA är ett protein som finns i celler och innehåller all genetisk information som är nödvändig för levande varelsers utveckling och funktion..
Genom att isolera DNA gräver forskare in i studien av hur ärftliga egenskaper överförs, varför kaliumfosfat är till stor hjälp.
I olika applikationer
Kalium K-fosfat3PO4 det tjänar:
- som ett kosttillskott,
- för elektrolytbyte,
- som en buffert, det vill säga som ett kemiskt system som gör det möjligt att kontrollera nivåerna av OH-joner- eller väte H+ i vattenlösning,
- för att sakta ner eller hämma tandförfall,
- som korrosionshämmare och antifouling agent,
- som ett ytbehandlingsmedel och ett beläggningsmedel,
- som frostskyddsmedel,
- i rengöringsprodukter.

Negativ aspekt för användning inom jordbruket
Vissa forskare fann att lägga till K3PO4 en mikrokultur av ris ökar utsläppet av metan (CH4) till atmosfären. Metan är en gas som bidrar till växthuseffekten och ökar temperaturen på vår planet.
Referenser
- USA National Library of Medicine. (2019). Kaliumfosfat. Återställd från pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Vätskebehandling vid endokrina och metabola störningar. Fosfor-tillskott. I vätske-, elektrolyt- och syrabasstörningar i smådjur (fjärde upplagan). Återställd från sciencedirect.com.
- Shenawi-Khalil, S. et al. (2012). Syntes av acetylener via dehydrobromering med användning av fast vattenfritt kaliumfosfat som bas under fasöverföringsbetingelser. Tetrahedron Letters, Volym 53, utgåva 18, 2012, sidorna 2295-2297. Återställd från sciencedirect.com.
- Guan, G. et al. (2009). Tri-kaliumfosfat som en fast katalysator för produktion av biodiesel från spillolja. Bränslebearbetningsteknik, Volym 90, utgåva 4, 2009, sidorna 520-524. Återställd från sciencedirect.com.
- Kulkami, M.A. (2012). Mekanistiskt tillvägagångssätt för snabb och lösningsmedelsfri syntes av α-hydroxifosfonater med kaliumfosfat som katalysator. Comptes Rendus Chimie, Vol 16, utgåva 2, 2013, sidorna 148-152. Återställd från sciencedirect.com.
- Venter, E. et al. (2014). Kaliumfosfat inducerar tolerans mot det ryska vätluset (Diuraphis noxia, Homoptera: Aphididae) i vete. Crop Protection Vol 61, juli 2014, sidorna 43-50. Återställd från sciencedirect.com.
- Bonturi, N. et al. (2013). Natriumcitrat och kaliumfosfat som alternativa adsorptionsbuffertar i hydrofob och aromatisk tiofil kromatografisk rening av plasmid-DNA från neutraliserat lysat. Journal of Chromatography B, Volumes 919-920, 2013, sidorna 67-74. Återställd från sciencedirect.com.
- Conrad, R. och Klose, M. (2005). Effekt av kaliumfosfatgödsling på produktion och utsläpp av metan och dess 13C-stabil isotopkomposition i rismikrokosmos. Soil Biology and Biochemistry, Vol 37, Issue 11, 2005, Pages 2099-2108. Återställd från sciencedirect.com.
- Lide, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Rökfot. (2019). Tripotiumfosfat. Återställd från en.wikipedia.org


Ingen har kommenterat den här artikeln än.