
Bakteriella utstrykningsegenskaper och beredning
De bakterieutstryk är en tunn filmförlängning av en suspension av bakteriella mikroorganismer som är gjord på en transparent glasplatta eller glid för observation under ett optiskt mikroskop.
Förlängningen i form av en film utförs för att separera mikroorganismerna så mycket som möjligt, eftersom om de är grupperade är observationen inte klar.
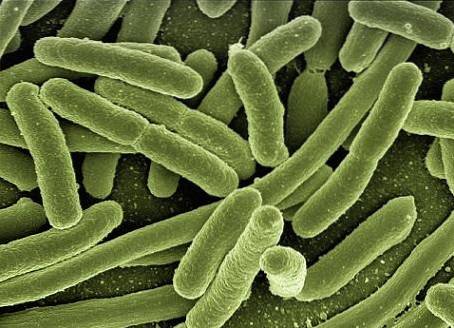
I studien av bakteriekulturer används smetberedning, fixering och färgningstekniker för att bättre analysera dem. På grund av den lilla storleken på mikroorganismer krävs användning av ett optiskt mikroskop nödvändigtvis för deras observation..
Optiska mikroskop är oumbärliga instrument för att observera utstryk. Dessa använder optiska linser och ljus som möjliggör visning av proverna med stor förstoring..
I allmänhet har levande celler inte mestadels färgade strukturer, sett med ljusmikroskopet är de färglösa, transparenta prover, och de visar väldigt liten inre kontrast och med sin miljö..
Observation med det enkla optiska mikroskopet med ljusfält, utan användning av hjälpfärgningstekniker, är mycket begränsat och används endast i vissa fall, såsom vid observation av mikroorganismernas rörelse..
För optimal observation av mikroorganismer måste en balans uppnås mellan kontrast och upplösning. Celldetaljer kan inte ses under mikroskopet, inte ens med hög upplösning; användningen av färgämnen krävs genom färgningstekniker, som ger kontrast för observation.
Artikelindex
- 1 Kännetecken för bakteriesmear av god kvalitet
- 1.1 Utmärkt kontrast
- 1.2 Bra fixering
- 1.3 Bra färgning
- 2 Förberedelse
- 2.1 A. Smet
- 2.2 B. Fixering
- 2.3 C. Enkel färgning
- 2.4 D. Definitivt bevarande av utstryket
- 3 Referenser
Kännetecken för ett bakteriellt utstryk av god kvalitet
Utmärkt kontrast
För att uppnå utmärkt kontrast finns sofistikerade mikroskop som kallas faskontrastmikroskop, differentiellt interferensmikroskop och mörkt fältmikroskop. Denna typ av mikroskop används för att observera bakteriestrukturer som mantlar och trådar, bland andra..
Färgning är en enkel teknik för att öka kontrasten som uppnås med ett ljusfältmikroskop. I denna teknik kan olika färgämnen användas som avsevärt förbättrar mikroskopisk observation..
Fläckarna utförs direkt på utstryk eller förlängningar av suspensioner av mikroorganismer på objektglasen, tidigare torkade och fixerade..
Bra fix
Fixering är en teknik som används för att bevara cellstrukturer; orsakar inaktivering av mikroorganismer och vidhäftning till objektglaset. Det finns olika fixeringsbehandlingar: värmefixering och kemisk fixering.
Värme fixering
Detta är den mest använda metoden för att observera bakterieutstryk. Tekniken består i att föra ut bakteriesuspensionen i smet genom tändarens låga. Denna teknik kan bevara bakteriers yttre morfologi men förstör deras inre strukturer..
Kemisk fixering
Kemisk fixering använder konserveringskemikalier, såsom formaldehyd eller formaldehyd, etanol och ättiksyra, bland andra. Fördelen med att använda kemiska fixeringsmedel är att konserveringen av de inre cellulära strukturerna i mikroorganismerna uppnås..
Bra färgning
De vanligaste procedurerna för färgning av en tidigare torkad och fixerad utstrykning är positiv eller enkel färgning, differentiell färgning och negativ färgning. Det finns också speciella tekniker för färgning av särskilda cellstrukturer (kapsel, spore, flagella).
Positiv färgning eller enkel färgning
Positiv eller enkel färgning är den mest använda fläckfärgningstekniken. Den använder färgämnen som har förmågan att binda till vissa mikrobiella strukturer, så att de kan observeras under ett mikroskop.
Dessa färgämnen har kromoforgrupper (färgad del) i sin kemiska struktur, med alternerande dubbelbindningar och enkelbindningar (konjugering). Dessa bindningar kan i sin tur skapa joniska eller kovalenta bindningar med vissa cellulära strukturer..
Fläckarna som används vid positiv eller enkel färgning är mestadels kemiska derivat av anilin (färgade organiska salter).
Å andra sidan, bland färgämnena kan vi hitta några med ett grundläggande pH och andra med ett surt pH..
Grundläggande färgämnen
I grundläggande färgämnen har kromoforgruppen en positiv elektrisk laddning. De allra flesta prokaryota mikroorganismer har ett neutralt inre pH-värde och deras cellyta är negativt laddad. Genom denna elektrostatiska interaktion binder kromoforen till cellen och fläckar den.
Exempel på basfärger är bland annat metylenblått, kristallviolett, malakitgrönt, basiskt fuscin, safranin..
Syrafärgämnen
I syrafärgämnen har kromoforgruppen en negativ elektrisk laddning. Dessa används för att färga proteiner med positivt laddade aminogrupper. Exempel på syrafärgämnen är syrafuscin, rosenbengal, Kongo-rött och eosin.
Differentiell färgning
Den differentiella färgningstekniken består av att applicera två färgämnen med olika färg eller intensitet för att skilja olika mikroorganismer under mikroskopet. Gramfläck och syra-alkoholresistensfläck är de mest använda differentiella fläckarna inom bakteriologi.
Gram-fläcken används som ett preliminärt test för att känna till form, storlek, cellgruppering och typ av cellvägg. Med hjälp av Gram-fläcktestet klassificeras cellväggsbakterier i Gram-positiva bakterier och Gram-negativa bakterier..
Negativ färgning
I denna teknik används kemiska färgämnen som inte tränger igenom cellens inre, men gör mediet i vilket mikroorganismerna visas som en svart bakgrund..
I den negativa färgningstekniken görs utstrykningen med en droppe Indien-bläck eller nigrosinsuspension, som efter att ha tillåtit torkning vid rumstemperatur bildar en film ogenomskinlig för ljusets passage. På detta sätt ses mikroorganismer som ljusa former på en mörk bakgrund..
Förberedelse
A. Smeta
1. - Tvätta objektglasen mycket väl, torka med absorberande papper och märka dem. Etiketten måste innehålla innehållet i beredningen, datum och namn på den person som bearbetade det..
2. - Tänd tändaren och sterilisera inokulationsslingan i lågan tills den är ljusröd.
3.- Låt handtaget svalna.
4. - Ta bakteriekulturröret, ta bort locket och passera snabbt rörets mynning nära brännarens flamma (flamma).
5.- För in inokulationsslingan i röret som innehåller bakteriekulturen och ta provet.
6. - Om kulturen är i flytande medium, placera provet som tagits med handtaget i mitten av objektglaset och sprid det försiktigt i en cirkel av cirka 2 cm i diameter..
7. - Sterilisera ympningsslingan igen.
8. - Låt utstryket torka i luften.
9.- Upprepa steg 3 till 8 tre gånger.
10. - Om kulturen är i fast medium måste en droppe destillerat vatten placeras tidigare på objektglaset. Detta görs för att blanda ett litet prov av kulturen som tagits med ympningsslingan, enligt anvisningarna i steg 2 till 5 (aseptiska förhållanden).
11. - Sprid det utspädda provet med droppen vatten på objektglaset och upprepa tre gånger.
B. Fixering
1.- Tillsätt två droppar metanol eller absolut etanol till de torra utstryk från kulturer i flytande medium..
2. - Låt lufttorka bort från tändaren.
3.- Om utstryket kommer från en odling på fast medium fixeras det torra utstrykningen med värme och passerar det snabbt 2-3 gånger genom den hetaste delen av den lättare lågan..
4. - Rör vid den nedre delen av utstrykningen med vänsterhandens ryggdel (för högerhänta; annars använd höger hand) och kontrollera att den är kall.
C. Enkel färgning
1.- Lägg till 2 droppar av den valda fläcken i utstrykningen och låt verka under den tid som krävs i de specifika protokollen för varje fläck (vanligtvis mellan 1 och 5 minuter).
2.- Vissa fläckar kräver användning av värme för att aktiveras, i vilket fall man måste vara mycket försiktig när man värmer bilden i den lättare lågan (manipulera den med en pincett och undvik kokning). En överhettning av smetan kan förstöra cellerna som ska observeras..
3.- Ta bort överflödigt färgämne genom att tvätta med destillerat vatten från en pikett. Ta bort tvättvattnet genom att knacka försiktigt på ramen på kanten, lutad på arbetsbordet.
4. - Låt lufttorka.
5.- Beroende på typ av observation används ett täckglas eller inte i detta skede. Täckglaset skyddar och bevarar utsmetningen. Om en oljedoppningsobservation görs i detta skede används inga täckglas men utstrykningen kan inte bevaras.
D. Definitivt bevarande av utstryket
1. - Sänk utstrykningen successivt i var och en av de lösningar som anges nedan, i minst 5 minuter. Syftet med dessa "bad" är att lämna utstrykningen helt uttorkad. Varje reagens bör dräneras ordentligt innan utstrykningen införs i nästa bad..
Dehydratiseringsbadens ordning är enligt följande:
- Etanol 70%
- Etanol 95%
- Ren aceton
- Aceton-xylol 1: 1 blandning
- Xylol
Låt sedan lufttorka.
2. - Montera täckglaset, helst 22 × 22 mm, med Canada balsam eller annat monteringsmedium.
Referenser
- Briggs, G. (1965). Orsaksmässiga faktorer vid mikrobiologiska laboratorieolyckor och infektioner. US Army Biological Laboratories. Fort detrick.
- Cappucino, J.G. och Welch, C.T. (2017). Mikrobiologi: En laboratoriehandbok. Pearson.
- Holt, J.G. Redaktör. (1977). Den kortare Bergey's Manual of Determinative Bacteriology. 8th Baltimore: Williams och Wilkins Co..
- Johnson, T.R. och fall; C.L. (2018). Laboratorieexperiment inom mikrobiologi. Pearson.
- Tille, P. (2017). Diagnostisk mikrobiologi. 14th St. Louis, USA: Elsiever, Inc.



Ingen har kommenterat den här artikeln än.