
Hexan (C6H14) fysikaliska och kemiska egenskaper, struktur, användningsområden, toxicitet
De hexan är ett kolväte kännetecknat av att det är en organisk förening vars kondenserade kemiska formel är C6H14. Det är en färglös, transparent vätska som inte kan blandas med vatten. Den har fem isomerer, den linjära är en av de viktigaste paraffiniska kolvätena inom industri och forskning.
Hexan erhålls genom fraktionerad destillation av råolja. På samma sätt är det naturligt närvarande i citrusfrukter och i flyktiga fraktioner av olika växter eller frukter som äpple, guava, rostade hasselnötter, sötpotatis och salvia..
Det är en mycket brandfarlig flyktig vätska som finns i bensin, snabbtorkande lim och gummicement. Hexan används som lösningsmedel i extraktionsprocessen av vegetabiliska oljor, liksom lipider och fetter som finns i förorenat vatten och jord.
Människor som exponeras professionellt för hexan kan uppleva perifera nervsystemskador, manifesterade av stickningar och kramper i ben och armar; förutom generaliserad muskelsvaghet och i svåra fall skelettmuskulär atrofi.
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos hexaner
- 1.1 Fysiskt utseende
- 1.2 Molmassa
- 1.3 Lukt
- 1.4 Lukttröskel
- 1.5 Densitet
- 1.6 Smältpunkt
- 1.7 Kokpunkt
- 1.8 Flampunkt
- 1.9 Löslighet i vatten
- 1.10 Löslighet i lösningsmedel
- 1.11 Relativ ångdensitet med luft
- 1.12 Fördelningskoefficient oktanol / vatten
- 1.13 Ångtryck
- 1.14 Våglängd med maximal optisk densitet
- 1.15 Brytningsindex
- 1.16 Viskositet
- 1.17 Kalorikapacitet
- 1.18 Förbränningsvärme
- 1.19 Förångningsvärme
- 1.20 Ytspänning
- 1.21 Joniseringspotential
- 1.22 Stabilitet
- 1.23 Reaktivitet
- 2 Konstruktion av hexan
- 2.1 Intermolekylära interaktioner
- 2.2 Isomerer
- 3 användningsområden
- 4 Toxicitet
- 4.1 Inandning och kontakt
- 4.2 Säker dos
- 5 Referenser
Fysikaliska och kemiska egenskaper hos hexaner
Fysiskt utseende
Färglös, transparent och mycket flyktig vätska.
Molmassa
86,178 g / mol
Odör
Liknar bensin
Lukttröskel
1,5 ppm
Densitet
0,6606 g / ml
Smältpunkt
-96 till -94 ºC
Kokpunkt
68,5 till 69,1 ºC
antändningspunkt
-22 ºC (sluten kopp).
Vattenlöslighet
9,5 mg / L (praktiskt taget ej blandbar med vatten)
Löslighet i lösningsmedel
Mycket löslig i etanol, löslig i etyleter och kloroform. Blandbar med alkohol, kloroform och eter.
Relativ ångdensitet med luft
2,97 (luft = 1)
Fördelningskoefficient oktanol / vatten
Logg P = 3764
Ångtryck
17,60 kPa vid 20 ºC
Våglängd med maximal optisk densitet
200 nm
Brytningsindex
1 375
Viskositet
0,3 mPa s
Kaloriförmåga
265,2 JK-1Mol-1
Förbränningsvärme
4 163,2 kJ mol-1
Förångningsvärme
31,56 kJ mol-1
Ytspänning
17,89 mN / m vid 25 ºC
Joniseringspotential
10,18 eV
Stabilitet
Stabil. Oförenlig med oxidationsmedel, klor, fluor, magnesiumperklorat. Bildar en explosiv blandning med luft.
Reaktivitet
Hexan kan reagera kraftigt med oxiderande material, som kan inkludera flytande klor, koncentrerat syre, natriumhypoklorit och kalciumhypoklorit. Det är också oförenligt med dinitrogen tetroxide. Hexan kan angripa vissa former av plast, gummi och beläggningar.
Struktur av hexan
Intermolekylära interaktioner
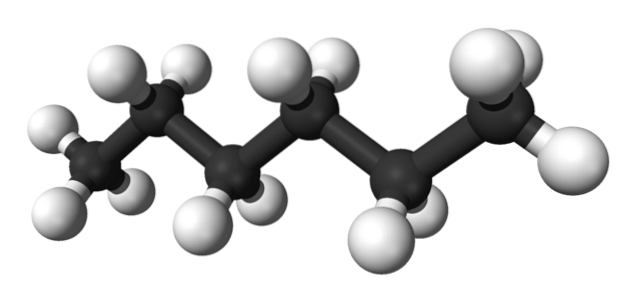
Den första bilden visar molekylen av n-hexan representerad av en kul-och-stick-modell. De svarta sfärerna motsvarar kolatomerna och utgör det sicksackande kolskelettet, medan de vita sfärerna är väteatomerna. De n-Hexan är därför ett kolväte, linjärt och mycket dynamiskt.
Eftersom alla dess C-H-bindningar har låg polaritet saknar molekylen ett dipolmoment. På så sätt är deras intermolekylära interaktioner inte av dipol-dipoltyp utan beror uteslutande på molekylmassa och Londons dispersiva krafter..
Varje molekyl av n-Hexan "passar" ovanpå varandra vid mycket låga temperaturer, vilket man antar i dess kristallstruktur. Å andra sidan, i vätskan böjs deras skelett och roterar sina C-H-bindningar, vilket får vätskan att vara flyktig och koka vid 68,7 ºC..
Isomerer
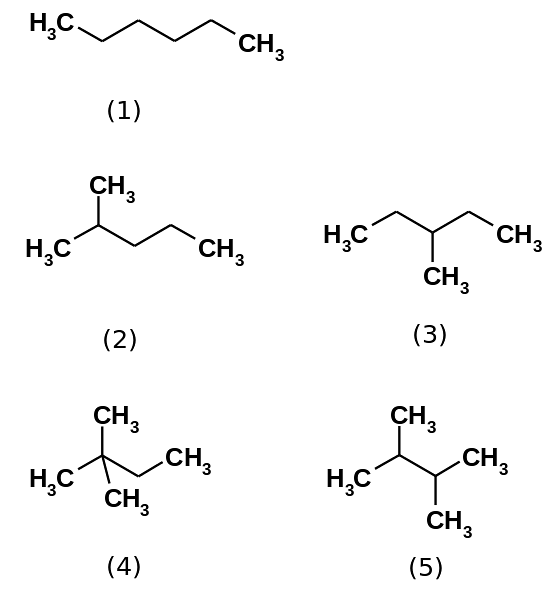
Kolvätehexanen består faktiskt av fem isomerer n-hexan minst grenad, (1). De andra fyra isomererna är i ökande ordning:
2-metylpropan (2)
3-metylpropan (3)
2,2-dimetylbutan (4)
2,3-dimetylbutan (5)
Observera också att strukturerna blir mer grenade från (1) till (5). Eftersom de är mer förgrenade minskar de dispersiva krafterna eftersom det inte längre finns linjära delar som kilar effektivt. Detta leder till en minskning och variation i isomerernas kokpunkter; även om vissa godtagbara avvikelser observeras.
Både 2-metylpropan (kp = 60,3 ° C) och 3-metylpropan (kp = 63,3 ° C) är lika grenade, men deras kokpunkter är olika. Sedan följs det av 2,3-dimetylbutan (peb = 58 ºC) för att slutligen lokalisera 2,2-dimetylbutan som den mest flyktiga vätskan (peb = 49,7 ºC).
Applikationer
Hexan blandas med liknande kemikalier för att producera lösningsmedel. Bland namnen på dessa lösningsmedel är kommersiell hexan, blandade hexaner etc. De används som rengöringsmedel inom textil-, möbel- och djuptryckindustrin..
Hexan är en ingrediens i lim som används i vattentäthet, skor och läder. Den används också för bindning av böcker, för gjutning av piller och tabletter, konservering, tillverkning av däck och baskulor..
Hexan används vid bestämning av brytningsindex för mineraler och fyllningsvätska för termometrar istället för kvicksilver. vanligtvis med en röd eller blå nyans. Det används också vid extraktion av fett och olja från vatten för analys av dess föroreningar..
Hexan används som lösningsmedel vid extraktion av olja från vegetabiliska frön, såsom sojabönor, raps eller björnbär. Dessutom används den för att avfetta delar av olika ursprung. Det används vid denaturering av alkohol, i HPLC-analysmetoden och i spektrofotometri.
Giftighet
Inandning och kontakt
Den akuta toxiciteten för hexan är relativt låg, även om det är ett milt bedövningsmedel. Akut exponering för höga koncentrationer av hexan kan orsaka, genom inandning, mild centrala nervsystemet (CNS) depression, som manifesteras av yrsel, yrsel, mild illamående och huvudvärk..
Det kan också orsaka dermatit och irritation i ögon och hals. Kronisk inandning av hexan, relaterad till arbetsaktivitet, kan orsaka skador på det perifera nervsystemet (sensorimotorisk polyneuropati).
De första symptomen är stickningar och kramper i ben och armar, följt av muskelsvaghet. I svåra fall kan skelettmuskulär atrofi uppstå tillsammans med förlust av koordination och synproblem.
Hexantoxicitet är relaterad till alstringen av hexan-2,5-dionmetaboliten. Det reagerar med aminosyran lysin i en proteinsidkedja, vilket orsakar förlust av proteinfunktion..
Säker dos
Enviromental Protection Agency (EPA) beräknade en referenskoncentration (RfC) för hexan på 0,2 mg / m3, och en referensdos (RfD) på 0,06 mg / kg kroppsvikt / dag.
På 1960- och 1970-talet hade en grupp arbetare inom skomakindustrin i Japan närvaron av nervstörningar. Orsaken var att de andades in en hexanatmosfär på 500 - 2500 ppm, i 8-14 timmar per dag.
Arbetarna uppvisade de kända symptomen på kronisk inandning av hexan och upptäckte läkarna att nerverna som kontrollerade armarna och benens muskler var skadade..
Referenser
- Danielle Reid. (2019). Hexan: struktur, formel och egenskaper. Studie. Återställd från: study.com
- Nationellt centrum för bioteknikinformation. (2019). Hexan. PubChem-databas. CID = 8058. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Hexan. Återställd från: en.wikipedia.org
- World of Molecules. (s.f.). Hexanmolekyl. Återställd från: worldofmolecules.com
- Kemikaliebok. (2017). Hexan. Återställd från: chemicalbook.com
- Australiens Commonwealth. (s.f.). n-hexan: Utsläppskällor. Återställd från: npi.gov.au
- EPA. (2000). Hexan. [PDF]. Återställd från: epa.gov
- Agency for Toxic Substances and Disease Register. (1999). Folkhälsoförklaring för n-Hexane. Återställd från: atsdr.cdc.gov



Ingen har kommenterat den här artikeln än.