
Cykliska kolväten struktur, egenskaper, exempel

De cykliska kolväten De är organiska föreningar som består av kol- och väteatomer som länkar för att bilda ringar eller cykliska strukturer. Det finns huvudsakligen av tre typer: alicykliska, aromatiska och polycykliska.
Dessa typer av kolväten kan sedan bestå av de slutna versionerna av alkaner, alkener och alkyner; har ringar med aromatiska system, såsom bensen och dess derivat; eller presentera invecklade och fascinerande strukturer. Av alla är alicykliska de enklaste och representeras vanligtvis med polygoner.
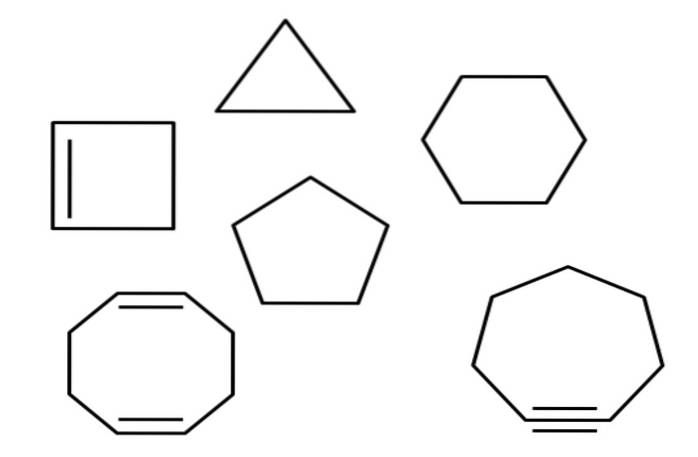
Ovan har du till exempel flera alicykliska kolväten. De ser ut som enkla polygoner: en fyrkant, triangel, femkant, sexkant etc. Om en av dess C-C-bindningar kunde skäras med en sax skulle resultatet bli en alkan, alken (om den har dubbelbindningar) eller alkyn (om den har trippelbindningar).
Deras egenskaper skiljer sig inte för mycket från de öppna kedjorna av kolväten som de härstammar från; även om kemiskt, ju större de är, desto stabilare blir de och deras interaktion med ett molekylärt medium blir mer uttalad (på grund av deras större kontaktyta).
Artikelindex
- 1 Struktur
- 1.1 Konformationer
- 2 fastigheter
- 2.1 Intermolekylära krafter
- 3 Nomenklatur
- 4 Exempel
- 5 Referenser
Strukturera
Om vi går direkt till saken som berör deras strukturer, bör det förtydligas att de inte är platta, även om de verkar så i deras framställning av polygoner. Det enda undantaget från detta uttalande finns i cyklopropan (triangeln), eftersom dess tre punkter nödvändigtvis måste vila på samma plan..
Det är också nödvändigt att klargöra att termerna "cykler" och "ringar" ofta är utbytbara. en ring behöver inte vara cirkulär och därför kan den få oändliga geometrier så länge det är en sluten struktur. Cyklopropan sägs sedan ha en triangulär ring eller cykel.
Alla kol har sp-hybridiseringar3, så deras geometrier är tetraedriska och deras bindningar bör helst separeras med en vinkel på 109,5 °; detta är emellertid inte möjligt för strukturer så stängda som cyklopropan, cyklobutan (kvadrat) eller cyklopentan (pentagon).
Vi talar då om en spänning som destabiliserar molekylen och bestäms experimentellt genom att mäta förbränningsvärdena för varje CH-grupptvå.
Konformationer
Och vad händer när det finns dubbla eller trippelbindningar? Spänningen ökar, för där det finns en av dem kommer strukturen att tvingas "krympa" och förbli platt; som, i följd, skulle tvinga en konformation över andra, förmodligen förmörka närliggande väteatomer.

I bilden ovan visas två konformatorer för cyklohexan för att försöka förklara ovanstående. Atomerna som är i positionerna till eller och de sägs vara axiella respektive ekvatoriella. Observera att i stället för en platt sexkant har du en stol (vänster) och en båt (höger).
Dessa strukturer är dynamiska och skapar en balans mellan dem. Om atomerna in till de är mycket voluminösa, ringen kommer att "rymma" för att placera dem i ekvatorialpositionerna; eftersom de är orienterade mot sidorna av ringen (vilket skulle förstärka eller försämra intermolekylära interaktioner).
Om vi tittar på varje kol separat kommer det att ses att de är tetraedriska. Detta skulle inte vara fallet om det fanns en dubbelbindning: deras sp-hybridiseringartvå de skulle tvinga strukturen att platta ut; och om det finns en trippelbindning, för att justera. Den plana strukturen för bensen är den maximala representationen av detta.
Egenskaper
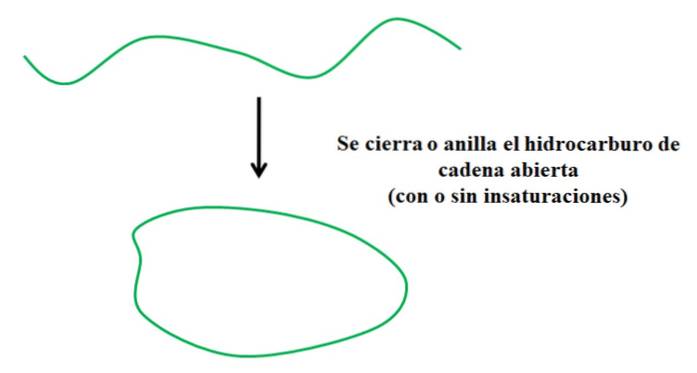
Antag att du har ett öppet kolväte (med eller utan omättningar eller grenar). Om vi kunde gå med i ändarna, skulle det skapa en ring eller cykel (som i bilden ovan).
Ur den organiska syntesens synvinkel händer detta inte bara så; det måste finnas goda lämnande grupper länkade i ändarna av kedjan, som när de lämnar främjar kedjestängningen (om lösningen är mycket utspädd).
Med detta i åtanke kan man se att det gröna spårkolvätet endast genomgår en transformation med avseende på dess struktur; utan att bryta eller lägga till nya bindningar med andra atomer. Det betyder att det kemiskt fortsätter att vara detsamma före och efter stängning eller bälte..
Därför skiljer sig inte de kemiska eller fysiska egenskaperna hos dessa alicykliska kolväten för mycket från deras motsvarigheter med öppen kedja. Båda är reaktiva mot samma art (dvs. halogener under ultraviolett ljus) och kan genomgå stark oxidation eller brännskada genom att släppa ut värme..
Intermolekylära krafter
Det finns ett obestridligt faktum: ringen har en större kontaktyta än den öppna kedjan, och därför är dess intermolekylära interaktioner starkare.
Resultatet är att deras kok- och smältpunkter tenderar att vara högre, liksom deras densiteter. Så många skillnader kan noteras i deras brytningsindex eller ångtryck.
Nomenklatur
När vi återgår till exemplet med kolväten med ett grönt slag, förblir dess nomenklatur oförändrad när den har stängt in sig själv (som en orm som biter i sin egen svans). Därför förblir namngivningsreglerna desamma; såvida inte polycykliska eller aromatiska kolväten adresseras.
Tre föreningar visas nedan, vilka kommer att ges deras riktiga namn:
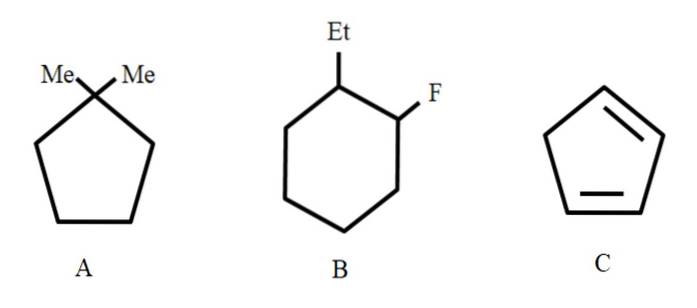
Till att börja med, eftersom de är slutna strukturer, används prefixcykeln för att hänvisa till dem (här förflyttas ordet ring).
Från vänster till höger har vi: en cyklopentan, en cyklohexan och en annan cyklopentan. Kolen listas på ett sådant sätt att substituenterna tilldelas de minsta siffrorna och de nämns också i alfabetisk ordning..
Således är A: 1,1-dimetylcyklopentan. I B börjar vi med att nämna etylsubstituenten före fluor, så dess namn är: 1-etyl-2-fluorcyklohexan. Och sedan för C tas dubbelbindningarna som substituenter, antalet kol som bildar det måste anges: 1,3-cyklopentadien.
Exempel
Under hela artikeln har flera cykliska kolväten nämnts. I den första bilden kan man hitta: cyklopropan, cyklobutan, cyklopentan, cyklohexan, cykloheptan och cyklooktan.
Ett brett spektrum av derivat kan erhållas från dem, och det räcker att placera dubbel- eller trippelbindningar på dem för att ha cykloalkener respektive cykloalkiner. Och med avseende på aromatiska kolväten räcker det att hålla bensenringen i åtanke och ersätta den eller reproducera den i två dimensioner..
Emellertid är de mest extraordinära (och problematiska när det gäller att förstå deras nomenklatur) polycykliska kolväten; det vill säga enkla polygoner räcker inte ens för att representera dem på ett enkelt sätt. Tre av dem som är värda att nämnas är: Kubanska, Canastano och Pagoda (bilder nedan).
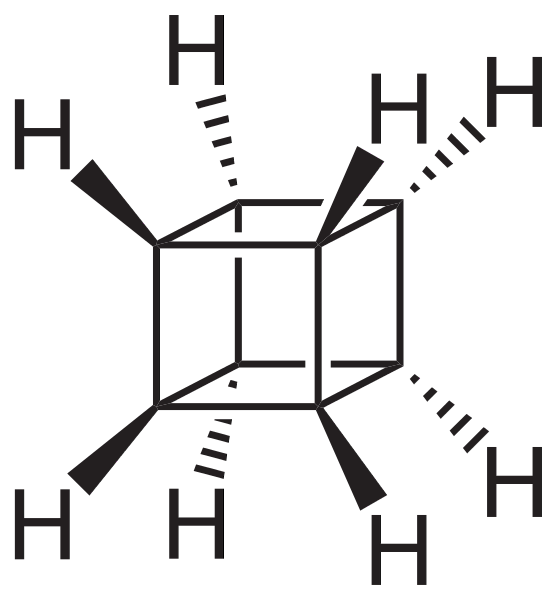
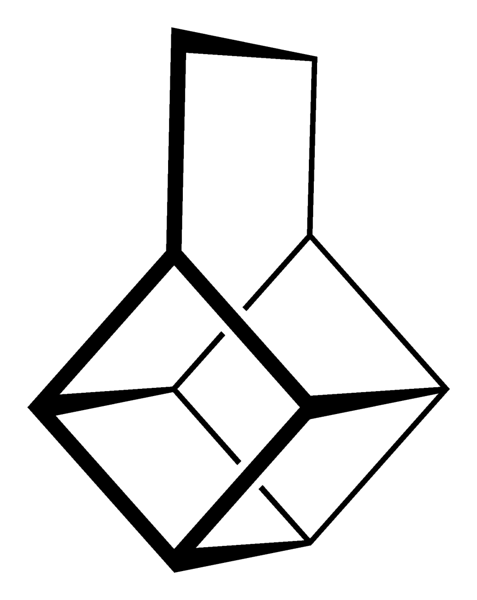

Var och en av dem har sin komplexa syntesmetodik, dess historia, konst och en latent fascination för de oändliga strukturella möjligheter som enkla kolväten kan nå..
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Reid Danielle. (2019). Cykliska kolväten: definition och exempel. Studie. Återställd från: study.com
- CK-12 Foundation. (05 juni 2019). Cykliska kolväten. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Wikipedia. (2019). Cyklisk förening. Återställd från: en.wikipedia.org
- Cowboy Miguel. (2019). Cykliska kolväten. Återställd från: deciencias.net



Ingen har kommenterat den här artikeln än.