
Bariumhydroxid (Ba (OH) 2) egenskaper, risker och användningar
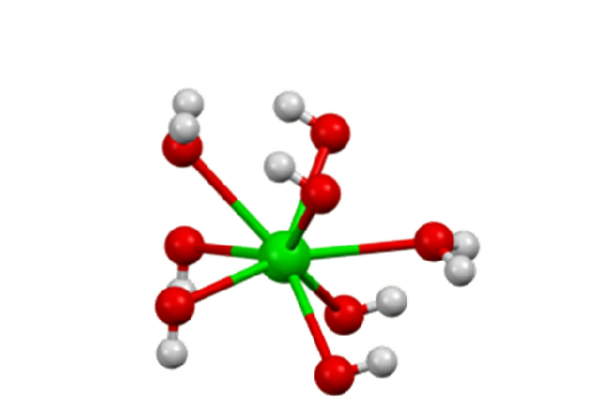
De bariumhydroxid är en kemisk förening med formeln Ba (OH)två(HtvåELLER)x. Det är en stark bas och kan vara i vattenfri, monohydrat- eller oktohydratform. Monohydratformen, även kallad baritvatten, är den vanligaste och används kommersiellt. Strukturen för de vattenfria och monohydratföreningarna presenteras i figur 1.
Bariumhydroxid kan framställas genom att lösa bariumoxid (BaO) i vatten: BaO + 9HtvåO → Ba (OH)två8HtvåO. Det kristalliserar sig som oktahydratet, som blir monohydrat när det värms upp i luft. Vid 100 ° C under vakuum producerar monohydrat BaO och vatten.
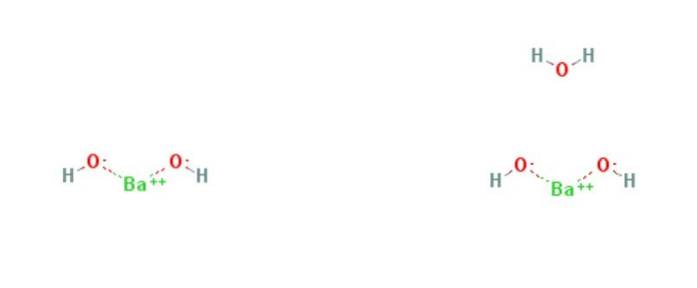
Monohydratet antar en skiktad struktur (figur 2). Ba centrerartvå+ de antar en oktaedrisk geometri. Varje centrum Batvå+ är bunden av två vattenligander och sex hydroxidligander, vilka är respektive dubbla och tredubbla överbryggade till Ba-centrentvå+ grannar.
I oktahydratet centrerar Batvå+ Individer är återigen åtta koordinater men delar inte ligander (Barium Hydroxide, S.F.).
Artikelindex
- 1 Egenskaper hos bariumhydroxid
- 2 Reaktivitet och faror
- 2.1 Ögonkontakt
- 2.2 Hudkontakt
- 2.3 Inandning
- 2.4 Förtäring
- 3 användningsområden
- 3.1 1- Industri
- 3.2 2- Laboratorium
- 3.3 3- Katalysator i Wittig-Horner-reaktionen
- 3.4 4- Andra användningsområden
- 4 Referenser
Bariumhydroxidegenskaper
Bariumhydroxid är vita eller genomskinliga oktaedriska kristaller. Luktfri och med en kaustisk smak (National Center for Biotechnology Information., 2017). Dess utseende visas i figur 3 (IndiaMART InterMESH Ltd., S.F.).

Den vattenfria formen har en molekylvikt på 171,34 g / mol, en densitet på 2,18 g / ml, en smältpunkt på 407 ° C och en kokpunkt på 780 ° C (Royal Society of Chemistry, 2015).
Monohydratformen har en molekylvikt på 189,355 g / mol, en densitet på 3,743 g / ml och en smältpunkt på 300 ° C (Royal Society of Chemistry, 2015).
Oktohydratformen har en molekylvikt på 315,46 g / mol, en densitet på 2,18 g / ml och en smältpunkt på 78 ° C (Royal Society of Chemistry, 2015).
Föreningen är lätt löslig i vatten och olöslig i aceton. Det är en stark bas med en pKa på 0,15 och 0,64 för den första och andra OH- respektive.
Bariumhydroxid reagerar på samma sätt som natriumhydroxid (NaOH) men är mindre löslig i vatten. Neutraliserar syror exotermiskt för att bilda salter plus vatten. Kan reagera med aluminium och zink för att bilda metalloxider eller hydroxider och generera vätgas.
Kan initiera polymerisationsreaktioner i polymeriserbara organiska föreningar, särskilt epoxider.
Det kan generera brandfarliga och / eller giftiga gaser med ammoniumsalter, nitrider, halogenerade organiska föreningar, olika metaller, peroxider och hydroperoxider. Blandningar med klorerade tandkött exploderar vid upphettning eller krossning (BARIUMHYDROXIDMONOHYDRAT, 2016).
Bariumhydroxid sönderdelas till bariumoxid vid upphettning till 800 ° C. Reaktion med koldioxid ger bariumkarbonat. Dess mycket alkaliska vattenhaltiga lösning genomgår neutraliseringsreaktioner med syror. Således bildar den bariumsulfat respektive bariumfosfat med svavelsyra respektive fosforsyra..
HtvåSW4 + Ba (OH)två Baso4 + 2HtvåELLER
Reaktion med vätesulfid ger bariumsulfid. Utfällning av många olösliga eller mindre lösliga bariumsalter kan bero på en dubbel ersättningsreaktion när en vattenhaltig lösning av bariumhydroxid blandas med många lösningar av andra metallsalter..
Blandning av den fasta hydratiserade bariumhydroxiden med fast ammoniumklorid i en bägare ger en endoterm reaktion för att producera en vätska med utvecklingen av ammoniak. Temperaturen sjunker drastiskt till cirka -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)två (s) + 2NH4Cl (s) → BaCltvå (aq) + 2NH3 (g) + HtvåELLER

Ba (OH) 2 reagerar med koldioxid för att producera bariumkarbonat. Detta uttrycks genom följande kemiska reaktion:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reaktivitet och faror
Bariumhydroxid klassificeras som en stabil, icke-brännbar förening som reagerar snabbt och exotermiskt med syror och är oförenlig med koldioxid och fukt. Föreningen är giftig och är som en stark bas frätande.
Inandning, förtäring eller hudkontakt med material kan orsaka allvarliga skador eller dödsfall. Kontakt med det smälta ämnet kan orsaka svåra brännskador på hud och ögon..
Hudkontakt bör undvikas. Effekterna av kontakt eller inandning kan försenas. Brand kan orsaka irriterande, frätande och / eller giftiga gaser. Brandavloppsvatten kan vara frätande och / eller giftigt och orsaka kontaminering.
Ögonkontakt
Om föreningen kommer i kontakt med ögonen bör kontaktlinserna kontrolleras och tas bort. Ögonen ska spolas omedelbart med mycket vatten i minst 15 minuter, med kallt vatten.
Hudkontakt
Vid hudkontakt ska det drabbade området sköljas omedelbart i minst 15 minuter med mycket vatten eller en svag syra, till exempel ättika, medan du tar bort förorenade kläder och skor. Täck irriterad hud med ett mjukgörande medel.
Tvätta kläder och skor före återanvändning. Om kontakten är svår, tvätta med desinfektionsmedel och täck den förorenade huden med en antibakteriell kräm..
Inandning
Vid inandning ska offret flyttas till en sval plats. Om du inte andas ges artificiell andning. Om det är svårt att andas, ge syre.
Förtäring
Om föreningen sväljs ska kräkningar inte induceras. Lossa trånga kläder som en skjortkrage, bälte eller slips.
I samtliga fall bör omedelbar läkarvård erhållas (Säkerhetsdatablad Bariumhydroxidmonohydrat, 2013).
Applikationer
1- Industri
Industriellt används bariumhydroxid som föregångare till andra bariumföreningar. Monohydrat används för att dehydrera och avlägsna sulfat från olika produkter. Denna applikation utnyttjar den mycket låga lösligheten av bariumsulfat. Denna industriella tillämpning gäller även för laboratorieändamål.
Bariumhydroxid används som tillsats i termoplaster (såsom fenolhartser), repor och PVC-stabilisatorer för att förbättra plastegenskaperna. Detta material används som ett allmänt tillsatsmedel för smörjmedel och fett..
Andra industriella tillämpningar av bariumhydroxid inkluderar tillverkning av socker, tillverkning av tvålar, fettförtvålning, silikatsmältning och kemisk syntes av andra bariumföreningar och organiska föreningar (BARIUMHYDROXID, S.F.).
2- Laboratorium
Bariumhydroxid används i analytisk kemi för titrering av svaga syror, särskilt organiska syror. Den klara vattenlösningen är garanterat karbonatfri, till skillnad från natriumhydroxid och kaliumhydroxid eftersom bariumkarbonat är olösligt i vatten.
Detta möjliggör användning av indikatorer som fenolftalein eller tymolftalein (med alkaliska färgförändringar) utan risk för titreringsfel orsakade av närvaron av karbonatjoner, som är mycket mindre grundläggande (Mendham, Denney, Barnes, & Thomas, 2000).
Bariumhydroxid används ibland i organisk syntes som en stark bas, till exempel för hydrolys av estrar och nitriler:
Bariumhydroxid används också vid dekarboxylering av aminosyror som frigör bariumkarbonat i processen..
Det används också vid beredning av cyklopentanon, diacetonalkohol och gamma - lakton D - Gulonic.
3- Katalysator i Wittig-Horner-reaktionen
Wittig-Horner-reaktionen, även känd som Horner-Wadsworth-Emmons-reaktionen (eller HWE-reaktionen) är en kemisk reaktion som används i organisk kemi för att stabilisera fosfonatkarbanjoner med aldehyder (eller ketoner) för att producera övervägande E-alkener (trans).
Den sonkemiska reaktionen Wittig-Horner katalyseras av aktiverad bariumhydroxid och utförs under gränsytor med fast vätska..
Den sonkemiska processen äger rum vid rumstemperatur och med en lägre katalysatorvikt och reaktionstid än den termiska processen. Under dessa förhållanden erhålls utbyten som liknar de för den termiska processen..
I arbetet med (J. V. Sinisterra, 1987) analyseras påverkan på ultraljudsbehandlingstiden, katalysatorns och lösningsmedlets vikt. Små mängder vatten måste tillsättas för att reaktionen ska kunna ske.
Arten av det aktiva stället för katalysatorn som verkar i processen analyseras. En ETC-mekanism föreslås för den sonokemiska processen.
4- Andra användningsområden
Bariumhydroxid har andra användningsområden. Den används för ett antal ändamål, till exempel:
- Tillverkning av alkali.
- Glaskonstruktion.
- Vulkanisering av syntetiskt gummi.
- Korrosionshämmare.
- Som borrvätskor, bekämpningsmedel och smörjmedel.
- För pannemedlet.
- För att förfina vegetabiliska och animaliska oljor.
- För freskomålning.
- I vattenmjukning.
- Som en ingrediens i homeopatiska läkemedel.
- För att rensa syrautsläpp.
- Det används också i sockerindustrin för att bereda sockerbetor.
- Byggmaterial.
- Elektriska och elektroniska produkter.
- Golvbeläggningar.
Referenser
- BARIUMHYDROXIDMONOHYDRAT. (2016). Återställd från cameochemicals: cameochemicals.noaa.gov.
- Bariumhydroxid. (S.F.). Återställd från chemistrylearner: chemistrylearner.com.
- BARIUMHYDROXID. (S.F.). Återställd från chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd ... (S.F.). Bariumhydroxid. Återställd från indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 som katalysator i organiska reaktioner. 17. Gränssnitt Wittig-Horner-reaktion med fast vätska under sonokemiska förhållanden. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Säkerhetsdatablad Bariumhydroxidmonohydrat. (2013, 21 maj). Hämtad från sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D., & Thomas, M. J. (2000). Vogels kvantitativa kemiska analys (6: e upplagan). New York: Prentice Hall.
- Nationellt centrum för bioteknikinformation. (2017, 28 mars). PubChem Compound Database; CID = 16211219. Återställd från PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Bariumhydroxid. Återställd från chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Bariumhydroxidhydrat (1: 2: 1). Återställd från chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Dihydroxibariumhydrat (1: 1). Återställd från chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Endotermiska fasta-fasta reaktioner. Återställd från: lär-kemi: rsc.org.



Ingen har kommenterat den här artikeln än.