
Berylliumhydroxid (Be (OH) 2) struktur, egenskaper och användningsområden

De berylliumhydroxid Det är en kemisk förening som består av två hydroxidmolekyler (OH) och en berylliummolekyl (Be). Dess kemiska formel är Be (OH)två och det kännetecknas av att vara en amfoter art. I allmänhet kan det erhållas från reaktionen mellan berylliummonoxid och vatten enligt följande kemiska reaktion: BeO + HtvåO → Be (OH)två
Å andra sidan har denna amfotera substans en linjär molekylär konfiguration. Olika strukturer kan emellertid erhållas från berylliumhydroxid: alfa- och beta-form, som mineral och i ångfas, beroende på vilken metod som används..
Artikelindex
- 1 Kemisk struktur
- 1.1 Alfa-berylliumhydroxid
- 1.2 Beta berylliumhydroxid
- 1.3 Berylliumhydroxid i mineraler
- 1.4 Berylliumhydroxidånga
- 2 fastigheter
- 2.1 Utseende
- 2.2 Termokemiska egenskaper
- 2.3 Löslighet
- 2.4 Exponeringsrisker
- 3 användningsområden
- 4 Skaffa
- 4.1 Erhålla metallisk beryllium
- 5 Referenser
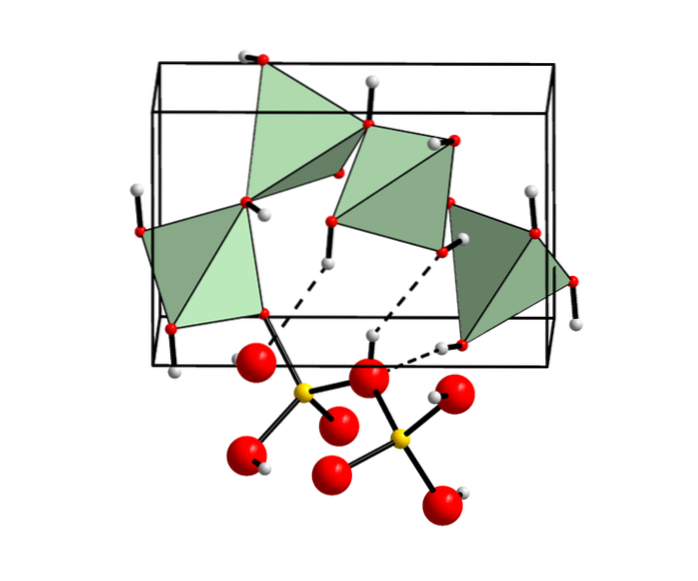
Kemisk struktur
Denna kemiska förening finns i fyra olika former:
Alpha berylliumhydroxid
Tillsats av vilket basiskt reagens som helst som natriumhydroxid (NaOH) till en berylliumsaltlösning ger alfa (α) -formen av berylliumhydroxid. Ett exempel visas nedan:
2NaOH (utspädd) + BeCltvå → Be (OH)två↓ + 2NaCl
2NaOH (utspädd) + BeSO4 → Be (OH)två↓ + NatvåSW4
Beta berylliumhydroxid
Degenerationen av denna alfaprodukt bildar en metastabil tetragonal kristallstruktur, som efter en längre tid förvandlas till en rombstruktur som kallas beta (β) berylliumhydroxid..
Denna beta-form erhålls också som en fällning från en natriumberylliumlösning genom hydrolys under förhållanden nära smältpunkten..
Berylliumhydroxid i mineraler
Även om det inte är vanligt, finns berylliumhydroxid som ett kristallint mineral som kallas behoite (benämnt på detta sätt med hänvisning till dess kemiska sammansättning).
Det förekommer i granitiska pegmatiter bildade genom förändring av Gadolinite (mineraler i silikatgruppen) i vulkaniska fumaroler.
Detta relativt nya mineral upptäcktes för första gången 1964, och för närvarande har de bara hittats i granitpegmatiter i delstaterna Texas och Utah i USA..
Berylliumhydroxidånga
Vid temperaturer över 1200 ° C (2190 ° C) finns berylliumhydroxid i ångfasen. Det erhålls från reaktionen mellan vattenånga och berylliumoxid (BeO).
På liknande sätt har den resulterande ångan ett partialtryck av 73 Pa, mätt vid en temperatur av 1500 ° C..
Egenskaper
Berylliumhydroxid har en ungefärlig molmassa eller molekylvikt av 43,0268 g / mol och en densitet av 1,92 g / cm3. Dess smältpunkt är vid en temperatur av 1000 ° C, vid vilken den börjar nedbrytas.
Som ett mineral, Be (OH)två (behoite) har en hårdhet på 4 och densiteten ligger mellan 1,91 g / cm3 och 1,93 g / cm3.
Utseende
Berylliumhydroxid är ett vitt fast ämne som i sin alfa-form har ett gelatinöst och amorft utseende. Å andra sidan utgör beta-formen av denna förening en väldefinierad, ortorombisk och stabil kristallstruktur..
Man kan säga att morfologin hos mineralet Be (OH)två den är varierad eftersom den kan hittas som retikulära, arborescerande kristaller eller sfäriska aggregat. På samma sätt kommer den i vita, rosa, blåaktiga och till och med färglösa färger och med en fet glaskropp..
Termokemiska egenskaper
Bildningens entalpi: -902,5 kJ / mol
Gibbs energi: -815,0 kJ / mol
Bildningsentropi: 45,5 J / mol
Värmekapacitet: 62,1 J / mol
Specifik värmekapacitet: 1443 J / K
Standardbildningens entalpi: -20,98 kJ / g
Löslighet
Berylliumhydroxid är amfotert till sin karaktär, så det kan donera eller acceptera protoner och löser sig i både sura och basiska medier i en syrabasreaktion, vilket ger salt och vatten..
I denna mening är lösligheten av Be (OH)två i vatten begränsas av löslighetsprodukten Kps(H2O), vilket är lika med 6,92 × 10-22.
Exponeringsrisker
Den tillåtna gränsen för exponering för människor (PEL eller OSHA) för ett berylliumhydroxidsubstans definierat för en maximal koncentration mellan 0,002 mg / m3 och 0,005 mg / m3 är 8 timmar och för en koncentration av 0,0225 mg / m3 en maximal tid på 30 minuter.
Dessa begränsningar beror på det faktum att beryllium klassificeras som cancerframkallande typ A1 (humant cancerframkallande, baserat på mängden bevis från epidemiologiska studier).
Applikationer
Användningen av berylliumhydroxid som råvara för bearbetning av en viss produkt är mycket begränsad (och ovanlig). Det är emellertid en förening som används som huvudreagens för syntes av andra föreningar och erhållande av metalliskt beryllium..
Erhållande
Berylliumoxid (BeO) är den mest använda kemiska föreningen för beryllium med hög renhet i industrin. Det kännetecknas som ett färglöst fast ämne med elektriska isoleringsegenskaper och hög värmeledningsförmåga.
I denna mening utförs processen för dess syntes (i teknisk kvalitet) i primärindustrin enligt följande:
- Berylliumhydroxid löses i svavelsyra (HtvåSW4).
- När reaktionen väl genomförts filtreras lösningen så att olösliga föroreningar av oxid eller sulfat på detta sätt elimineras..
- Filtratet utsätts för avdunstning för att koncentrera produkten, som kyls för att erhålla kristaller av berylliumsulfat BeSO4.
- Kyssen4 kalcinerar vid en specifik temperatur mellan 1100 ° C och 1400 ° C.
Slutprodukten (BeO) används för att tillverka speciella keramiska bitar för industriellt bruk..
Erhåller metallisk beryllium
Under utvinning och bearbetning av berylliummineraler genereras föroreningar, såsom berylliumoxid och berylliumhydroxid. Den senare utsätts för en serie transformationer tills metallberyllium erhålls.
Be (OH) reagerastvå med en ammoniumbifluoridlösning:
Be (OH)två + 2 (NH4) HFtvå → (NH4)tvåBeF4 + 2 timmartvåELLER
(NH4)tvåBeF4 utsätts för en temperaturökning, genomgår termisk nedbrytning:
(NH4)tvåBeF4 → 2NH3 + 2HF + BeFtvå
Slutligen resulterar reduktion av berylliumfluorid vid en temperatur av 1300 ° C med magnesium (Mg) i metalliskt beryllium:
BeFtvå + Mg → Var + MgFtvå
Beryllium används i metalllegeringar, produktion av elektroniska komponenter, tillverkning av skärmar och strålningsfönster som används i röntgenmaskiner..
Referenser
- Wikipedia. (s.f.). Berylliumhydroxid. Återställd från en.wikipedia.org
- Holleman, A. F.; Wiberg, E. och Wiberg, N. (2001). Berylliumhydroxid. Erhålls från books.google.co.ve
- Publishing, M. D. (s.f.). Behoite. Återställd från handbookofmineralogy.org
- Alla reaktioner. (s.f.). Berylliumhydroxid Be (OH)två. Hämtad från allreations.com
- PubChem. (s.f.). Berylliumhydroxid. Återställd från pubchem.ncbi.nlm.nih.gov
- Walsh, K. A. och Vidal, E. E. (2009). Beryllium kemi och bearbetning. Erhålls från books.google.co.ve


Ingen har kommenterat den här artikeln än.