
Immunoglobulin D-struktur, funktion och normala värden

De immunglobulin D (IgD), upptäckt 1965, är ett ytimmunoglobulin som finns (tillsammans med IgM) i membranet av B-lymfocyter (mIgD) innan de aktiveras.
Det har sin funktion som den initiala receptorn för antigener. IgD är också fritt i plasma tack vare dess utsöndring (sIgD). Den har en molekylvikt på 185 000 Dalton och representerar cirka 1% av immunglobulinerna i en organism.
Artikelindex
- 1 Vad är immunglobuliner?
- 2 Struktur
- 3 Funktion och sjukdomar
- 3.1 sIgD
- 3,2 mIgD
- 3,3 B-lymfocyter
- 3.4 Immuninflammatoriskt system
- 4 Normala värden
- 4.1 Serumkoncentration
- 4.2 Blodvärden
- 5 Referenser
Vad är immunglobuliner?
Immunglobuliner eller antikroppar är högspecifika komplexa globulära glykoproteiner syntetiserade av B-lymfocyter, celler som är ansvariga för immunsvaret i djurens kropp..
Immunglobuliner interagerar med molekyler som kroppen identifierar som icke-jag eller antigener. Varje substans som kan aktivera immunsvaret i kroppen kallas ett antigen..
Familjen av Ig-antikroppsmolekyler inkluderar de som cirkulerar i blodplasma och de på ytan av B-lymfocyter innan de aktiveras..
Det finns fem typer av immunglobuliner: IgG, IgD, IgE, IgA och IgM (identifierade hos människor, möss, hundar, reptiler, fisk, bland andra), som skiljer sig strukturellt genom sina konstanta regioner i den tunga kedjan. Dessa skillnader ger dem särskilda funktionella egenskaper.
Antikroppar fungerar som specifika sensorer för antigener. Med dessa bildar de komplex som initierar en kaskad av reaktioner som är typiska för immunsystemet. De allmänna stadierna i denna process är: igenkänning, differentiering av specifika lymfocyter och slutligen effektorstadiet.
Strukturera
Alla antikroppar är komplexa polypeptidmolekyler formade som ett "Y". De består av fyra polypeptidkedjor, två av dem är identiska lätta (korta) kedjor med cirka 214 aminosyror vardera, och de andra två tunga (långa) kedjorna är också identiska med varandra, dubbelt så många aminosyror. En disulfidbindning länkar en lätt kedja till en tung kedja.
Båda typerna av kedjor har konstanta regioner (karakteristiska för typen av antikropp och den art som organismen tillhör), där aminosyrasekvensen upprepas från en molekyl till en annan, och de har också variabla regioner av cirka 100 aminosyror i längd..
En disulfidbrygga (kovalent typbindning) förenar varje lätt kedja till en tung kedja och i sin tur kan en eller två av dessa bindningar sammanfoga de två tunga kedjorna.
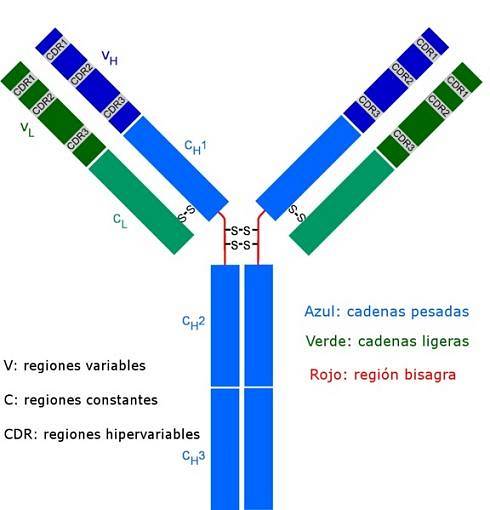
Dessa platser är de som binder som en handske till en viss region av det specifika antigenet, epitopen eller den antigena determinanten. Stabiliseringen av denna interaktion sker tack vare många icke-kovalenta bindningar.
Dessa CDR-sekvenser är mycket varierande bland antikroppar och genererar specificitet för olika typer av antigener..
Beträffande särdragen hos immunoglobulin D är det känt att det uppvisar en stor mångfald bland ryggradsdjur. I stort sett består den av två delta tunga kedjor och två lätta kedjor. IgD är antingen fritt i serum eller bundet till B-lymfocyter genom en Fc-receptor..
Funktion och sjukdomar
Eftersom IgD evolutionsmässigt har bevarats från broskfisk (som befolkade planeten för ungefär 500 miljoner år sedan) till människor tros det tjäna vitala immunfunktioner.
Trots detta har det varit den minst studerade av immunglobulinerna, för vilka de specifika funktionerna av sIgD i serum ännu inte är kända exakt, medan flera funktioner har föreslagits för mIgD.
sIgD
En av orsakerna till det senaste intresset för studien av sIgD har varit upptäckten av höga nivåer av denna Ig hos vissa barn med periodisk feber. I sin tur är en annan intressant faktor dess användbarhet vid övervakning av myelom..
SIgD antas spela en roll i blodet, slemhinnesekretionerna och på ytan av medfödda immuneffektorceller, såsom basofiler.
De är mycket reaktiva mot patogener i andningsorganen och deras utsöndringsprodukter. IgD har rapporterats öka mucosal immunitet, tack vare dess effekt på närvarande bakterier och virus.
mIgD
När det gäller mIgD betraktas det som en membranantigenreceptor för B-lymfocyter, vilket skulle gynna cellmognad. I sin tur tros det vara en ligand för IgD-receptorer vid immunreglering av T-hjälparceller..
B-lymfocyter
IgD-producerande B-lymfocyter antas representera en viss celllinje som kallas B-1-lymfocyter. Dessa är självreaktiva lymfocyter som har undgått klonradetionen.
Autoantikropparna som genereras av dessa lymfocyter reagerar med deoxiribonukleinsyra eller DNA (enkel och dubbelsträngad), med cellreceptorer, cellmembran i röda blodkroppar och epitelvävnad..
Det är så de genererar autoimmuna sjukdomar, såsom systemisk lupus erythematosus, myasteni gravis, autoimmun hemolytisk anemi och idiopatisk trombocytopeni purpura.
Immuninflammatoriskt system
Det är också känt att IgD är inblandade i orkestrering av ett system som stör immun- och inflammatoriska system: höga koncentrationer av IgD är relaterade till autoinflammatoriska störningar (hyperimmunoglobulemia syndrom D, HIDS eller hyper-IgD).
Till exempel, hos patienter med autoimmuna tillstånd, såsom reumatoid artrit, finns förhöjda värden för både sIgD och mIgD. Man tror därför att detta tillstånd bidrar till sjukdomens patogenes.
De möjliga funktionerna hos denna antikropp i perifera mononukleära celler (PBMC) från dessa patienter studeras för närvarande. Allt detta har lett till att man anser att IgD kan vara ett potentiellt immunterapeutiskt mål vid behandling av reumatoid artrit.
Normala värden
SIgD hos normala individer varierar mycket, vilket har gjort det svårt att fastställa ett exakt referensintervall för deras normala koncentrationer. Vissa studier har visat att denna variation särskilt påverkas av:
- Känsligheten för den tillämpade detekteringstekniken - både genom radioimmunanalyser (RIA), enzymimmunanalyser (EIA) och det vanligaste i kliniska laboratorier som är radioimmundiffusion (RID)-.
- Frånvaron av en enda fastställd universell metod för detektion av IgD.
- Ärftliga faktorer, ras, ålder, kön, graviditetsstatus, rökstatus, bland andra
Vissa specialister anser till och med att rutinanalysen av IgD inte är berättigad, eftersom dess specifika roll långt ifrån klargörs och kostnaderna för analysen i det kliniska laboratoriet är höga. Det skulle bara vara motiverat i fall av patienter med serum monoklonalt IgD eller misstänkt för att ha HIDS.
Serumkoncentration
Å andra sidan är det känt att sIgD i allmänhet har en serumkoncentration lägre än den för IgG, IgA och IgM, men högre än koncentrationen av IgE..
Eftersom den dessutom har en halveringstid på 2 till 3 dagar är plasmakoncentrationen mindre än 1% av det totala immunglobulinet i serum. Viss forskning tyder på att den representerar 0,25% av det totala serumimmunoglobulinet.
Blodvärden
Bland de rapporterade värdena på sIgD i blod har det hos nyfödda varit 0,08 mg / L (bestämt av RIA), hos spädbarn och vuxna varierar det från oupptäckbara värden till 400 mg / L (beroende på ålder och individer för varje enskild).
Hos normala vuxna har de rapporterats som normala medelvärden 25; 35; 40 och 50 mg / L. Generellt sett har den genomsnittliga serumkoncentrationen för friska vuxna rapporterats som 30 mg / L (bestämd av RID)..
Som det diskuteras i den här artikeln finns det dock många faktorer som förhindrar att ett antal normala standardvärden fastställs..
Referenser
- Chen, K. och Cerutti, A. (2011). Funktionen och regleringen av immunglobulin D.. Nuvarande åsikt inom immunologi, 23 (3), 345-52.
- Harfi, A. H. och Godwin, J.T. (1985). Normala serumnivåer av IgG, IgA, IgM, IgD och IgE i Saudiarabien. Annals of Saudi Medicine, Vol 5, nr 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. och Buckley, R.H. (1980). Serum IgD-koncentrationer hos normala spädbarn, barn och vuxna och hos patienter med förhöjt IgE. The Journal of Pediatrics, Vol. 96, nr 3, sid 417-420.
- Vladutiu, A.O. (2000). Immunoglobulin D: egenskaper, mätning och klinisk relevans. Klinisk och diagnostisk laboratorieimmunologi, 7(2), 131-40.
- Voet, J.G. och Voet, W.P.D. (2005). Fundamentals of Biochemestry: Lyfe på molekylär nivå. Wiley. sid 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. och Wei, W. ( 2016). Det förhöjda utsöndrade immunglobulin D förbättrade aktiveringen av perifera mononukleära blodceller vid reumatoid artrit. PloS one, 11 (1). doi: 10.1371 / journal.pone.0147788



Ingen har kommenterat den här artikeln än.