
Henry's Law Equation, Deviation, Applications
De Henrys lag anger att vid en konstant temperatur är mängden gas upplöst i en vätska direkt proportionell mot dess partiella tryck på vätskans yta.
Det postulerades 1803 av den engelska fysikern och kemisten William Henry. Hans lag kan också tolkas på detta sätt: om trycket på vätskan ökar, desto större blir mängden gas upplöst i den..

Här betraktas gasen som lösningsmedlets lösning. Till skillnad från fast löst ämne har temperaturen en negativ effekt på dess löslighet. När sålunda temperaturen ökar tenderar gasen att fly från vätskan lättare mot ytan..
Detta beror på att temperaturökningen bidrar med energi till de gasformiga molekylerna som kolliderar med varandra för att bilda bubblor (toppbild). Dessa bubblor övervinner sedan det yttre trycket och flyr från vätskans sinus..
Om det yttre trycket är mycket högt och vätskan hålls kall, kommer bubblorna att lösas upp och bara några gasformiga molekyler kommer att "sväva" på ytan.
Artikelindex
- 1 Henry's Law Equation
- 2 Avvikelse
- 3 Löslighet för en gas i vätskan
- 3.1 Omättad
- 3.2 Mättad
- 3.3 övermättad
- 4 applikationer
- 5 Exempel
- 6 Referenser
Henry's Law Equation
Det kan uttryckas med följande ekvation:
P = KH∙ C
Där P är partiellt tryck för den upplösta gasen; C är gaskoncentrationen; och KH är Henry konstant.
Det är nödvändigt att förstå att det partiella trycket hos en gas är det som utövas individuellt av en art av resten av den totala gasblandningen. Och det totala trycket är inget annat än summan av alla partiella tryck (Daltons lag):
PTotal= P1 + Ptvå + P3+... + Pn
Antalet gasformiga arter som utgör blandningen representeras av n. Till exempel om det finns vattenånga och CO på ytan av en vätskatvå, n är lika med 2.
Avvikelse
För gaser som är svagt lösliga i vätskor är lösningen nästan idealisk, i enlighet med Henrys lag för lösningsmedlet.
Men när trycket är högt finns det en avvikelse med avseende på Henry, eftersom lösningen slutar fungera som en ideal utspädd.
Vad betyder det? Att interaktioner mellan lösningsmedel och lösningsmedel börjar ha sina egna effekter. När lösningen är mycket utspädd, omges gasmolekylerna "uteslutande" av lösningsmedel och försummar de möjliga mötena emellan..
Därför, när lösningen inte längre späds idealt, observeras förlusten av linjärt beteende i P-grafeni mot Xi.
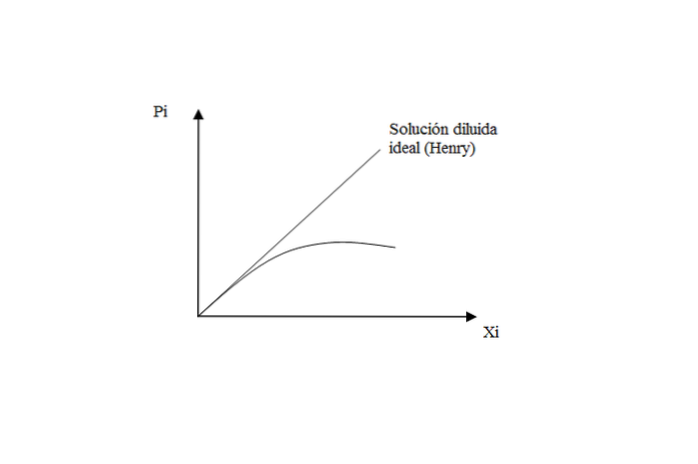
Avslutningsvis med denna aspekt: Henrys lag bestämmer ångtrycket hos en löst substans i en ideal utspädd lösning. Medan för lösningsmedlet gäller Raoults lag:
PTILL = XTILL∙ PTILL*
Löslighet för en gas i vätskan

När en gas är väl upplöst i en vätska, såsom socker i vatten, kan den inte särskiljas från omgivningen och bildar således en homogen lösning. Med andra ord: inga bubblor observeras i vätskan (eller sockerkristaller).
Den effektiva lösningen av gasformiga molekyler beror dock på vissa variabler som: vätskans temperatur, trycket som påverkar den och den kemiska naturen hos dessa molekyler jämfört med vätskans..
Om det yttre trycket är för högt ökar chanserna för att gas tränger in i vätskeytan. Och å andra sidan har de upplösta gasformiga molekylerna svårare att övervinna det infallande trycket för att fly till utsidan..
Om vätskegassystemet är under omrörning (som sker i havet och i luftpumparna inuti akvariet) gynnas absorptionen av gas.
Och hur påverkar lösningsmedlets natur absorptionen av en gas? Om det är polärt, som vatten, kommer det att visa affinitet för polära lösta ämnen, det vill säga för de gaser som har ett permanent dipolmoment. Medan det är apolärt, som kolväten eller fett, föredrar det apolära gasformiga molekyler
Till exempel ammoniak (NH3) är en mycket löslig gas i vatten på grund av vätebindningsinteraktioner. Medan väte (Htvå), vars lilla molekyl är apolär, interagerar svagt med vatten.
Beroende på tillståndet för gasabsorptionsprocessen i vätskan kan också följande tillstånd fastställas i dem:
Omättad
Vätskan är omättad när den kan lösa upp mer gas. Detta beror på att det yttre trycket är högre än vätskans inre tryck..
Mättad
Vätskan skapar en jämvikt i gasens löslighet, vilket innebär att gasen släpper ut i samma takt som den tränger igenom vätskan..
Det kan också ses på följande sätt: om tre gasformiga molekyler flyr ut i luften kommer ytterligare tre att återgå till vätskan samtidigt.
Övermättad
Vätskan är övermättad med gas när dess inre tryck är högre än det yttre trycket. Och med en minsta förändring i systemet kommer det att frigöra överflödigt upplöst gas tills jämvikt återställs.
Applikationer
- Henrys lag kan tillämpas för att göra absorptionsberäkningar av inerta gaser (kväve, helium, argon, etc.) i de olika vävnaderna i människokroppen, och som tillsammans med Haldanes teori är grunden för dekompressionstabellerna.
- En viktig tillämpning är blodgasmättnad. När blod är omättat löses gasen upp i det tills det blir mättat och slutar lösa ytterligare. När detta händer passerar gasen i blodet upp i luften..
- Förgasning av läsk är ett exempel på tillämpad Henrys lag. Läsk har COtvå upplöstes under högt tryck, vilket bibehåller var och en av de kombinerade komponenterna som utgör den; och dessutom bevarar den den karakteristiska smaken mycket längre.
När läskflaskan är täckt minskar trycket över vätskan, vilket frigör trycket direkt.
Eftersom trycket på vätskan nu är lägre är lösligheten av COtvå faller ner och flyr ut i miljön (kan ses i bubblornas uppgång från botten).

- När en dykare sjunker ner till större djup kan inhalerat kväve inte komma undan eftersom yttre tryck förhindrar det och löses upp i individens blod.
När dykaren snabbt stiger upp till ytan, där det yttre trycket sjunker igen, börjar kväve att bubbla in i blodet..
Detta orsakar så kallad dekompressionssjuka. Det är av den anledningen som dykare måste stiga långsamt, så att kväve flyr långsammare från blodet..
- Studie av effekterna av minskningen av molekylärt syre (Otvå) upplöst i blod och vävnader hos bergsklättrare eller utövare av aktiviteter som involverar längre vistelse på höga höjder, liksom hos invånarna på ganska höga platser.
- Forskning och förbättring av de metoder som används för att undvika naturkatastrofer som kan orsakas av närvaron av upplösta gaser i stora vattenmassor som kan släppas våldsamt.
Exempel
Henrys lag gäller endast när molekylerna är i jämvikt. Här är några exempel:
- I upplöst syre (Otvå) i blodvätska anses denna molekyl dåligt löslig i vatten, även om dess löslighet ökar kraftigt av det höga innehållet av hemoglobin i den. Således kan varje hemoglobinmolekyl binda till fyra syremolekyler som frigörs i vävnaderna för att användas i ämnesomsättningen.
- 1986 registrerades ett tjockt moln av koldioxid som plötsligt utvisades från sjön Nyos (som ligger i Kamerun) och kvävde cirka 1700 personer och ett stort antal djur, vilket förklarades av denna lag..
- Lösligheten som en viss gas manifesterar i en flytande art tenderar att öka när trycket hos nämnda gas ökar, även om det vid höga tryck finns vissa undantag, såsom kväve-molekyler (Ntvå).
- Henrys lag är inte tillämplig när det finns en kemisk reaktion mellan ämnet som fungerar som ett löst ämne och det som fungerar som ett lösningsmedel; så är fallet med elektrolyter, såsom saltsyra (HCl).
Referenser
- Crockford, H.D., Knight Samuel B. (1974). Grundläggande fysikokemi. (6: e upplagan). Ledare C.E.C.S.A., Mexiko. P 111-119.
- Redaktörerna för Encyclopaedia Britannica. (2018). Henrys lag. Hämtad den 10 maj 2018 från: britannica.com
- Byju's. (2018). Vad är Henrys lag? Hämtad den 10 maj 2018 från: byjus.com
- Leisurepro & Aquaviews. (2018). Henrys lag Hämtad den 10 maj 2018 från: leisurepro.com
- Annenberg Foundation. (2017). Avsnitt 7: Henrys lag. Hämtad den 10 maj 2018 från: learner.org
- Monica Gonzalez. (25 april 2011). Henrys lag. Hämtad den 10 maj 2018 från: quimica.laguia2000.com
- Ian Myles. (24 juli 2009). Dykare. [Figur]. Hämtad den 10 maj 2018 från: flickr.com



Ingen har kommenterat den här artikeln än.