
Ritchter-Wenzels lagberättelser, uttalanden och exempel

De Ritchter-Wenzels lag eller av de ömsesidiga proportionerna är en som fastställer att massproportionerna mellan två föreningar gör det möjligt att bestämma den för en tredje förening. Det är en av stökiometriens lagar, tillsammans med Lavoisiers lag (lag om bevarande av massa); Prousts lag (lag med bestämda proportioner); och Daltons lag (lag med flera proportioner).
Ritcher förklarade sin lag 1792 i en bok som definierade grundläggande stökiometri, baserat på forskningsverken från Carl F Wenzel, som 1777 publicerade den första ekvivalensbordet för syror och baser..
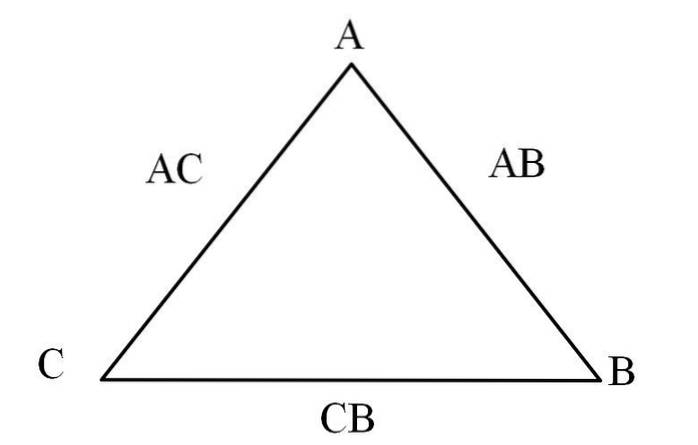
Ett enkelt sätt att visualisera det är genom en ”ömsesidig triangel” (bilden ovan). Om du känner till massorna A, C och B som blandas för att bilda föreningarna AC och AB kan du bestämma hur mycket av C och B som blandas eller reagerar för att bilda förening CB.
I föreningarna AC och AB finns element A i båda, så genom att dela deras massproportioner kommer det att ta reda på hur mycket C reagerar med B.
Artikelindex
- 1 Historik och allmänna lagar av ömsesidiga proportioner
- 2 Uttalanden och konsekvenser
- 3 Exempel
- 3.1 Kalciumklorid
- 3.2 Svaveloxider
- 3.3 Järnsulfid och oxid
- 4 Referenser
Historia och allmänna lagar av ömsesidiga proportioner
Richter fann att viktförhållandet för de föreningar som konsumeras i en kemisk reaktion alltid är detsamma.
I detta avseende fann Ritcher att 615 viktdelar magnesia (MgO) krävs, till exempel för att neutralisera 1000 viktdelar svavelsyra.
Mellan 1792 och 1794 publicerade Ritcher en sammanfattning av tre volymer som innehöll sitt arbete om lagen med bestämda proportioner. Abstraktet handlade om stökiometri och definierade det som kemiska mätningar..
Noterar vidare att stökiometri handlar om lagarna enligt vilka ämnen förenas för att bilda föreningar. Richters forskningsarbete kritiserades emellertid för den matematiska behandlingen han använde, och det påpekades till och med att han justerade sina resultat.
1802 publicerade Ernst Gottfried Fischer den första tabellen över kemiska ekvivalenter, som använde svavelsyra med siffran 1000; liknande det värde som hittades av Richter, för neutralisering av svavelsyra genom magnesia.
Det har emellertid noterats att Richter konstruerade en tabell över kombinationsvikter som indikerade den hastighet med vilken ett antal föreningar reagerade. Till exempel anges att 859 delar NaOH neutraliserar 712 delar HNO3.
Uttalanden och konsekvenser
Uttalandet av Richter-Wenzel-lagen är följande: massorna av två olika element som kombineras med samma mängd av ett tredje element, håller samma förhållande som massorna av dessa element när de kombineras med varandra.
Denna lag gjorde det möjligt att fastställa motsvarande vikt, eller vikt-ekvivalent gram, som mängden av ett element eller en förening som kommer att reagera med en fast mängd av ett referensämne.
Richter kallade kombinationsvikter i förhållande till vikten hos elementen som kombinerades med varje gram väte. De relativa kombinationsvikterna för Richter motsvarar det som för närvarande är känt som ekvivalentvikten för elementen eller föreningarna.
I enlighet med det tidigare tillvägagångssättet kan Richter-Wenzel-lagen anges på följande sätt:
Kombinationsvikterna för olika element som kombineras med en given vikt för ett visst element är de relativa kombinationsvikterna för dessa element när de kombineras med varandra, eller multiplar eller delmultipler av dessa kvantitetsförhållanden.
Exempel
Kalciumklorid
I kalciumoxid (CaO) kombineras 40 g kalcium med 16 g syre (O). Under tiden, i hypokloroxid (Cltvå71 g klor kombineras med 16 g syre. Vilken förening skulle kalcium göra om den kombinerades med klor?
Genom att använda triangeln av ömsesidighet är syre det vanliga elementet för de två föreningarna. Massproportionerna för de två oxygenaten bestäms först:
40 g Ca / 16 gO = 5 g Ca / 2 g O
71 g Cl / 16 g O
Och nu delar vi de två massproportionerna CaO och CltvåEller så har vi:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Observera att massförhållandena är uppfyllda: 40 g kalcium reagerar med 71 g klor.
Svaveloxider
Syre och svavel reagerar med koppar för att ge kopparoxid (CuO) respektive kopparsulfid (CuS). Hur mycket svavel skulle reagera med syre?
I kopparoxid kombineras 63,5 g koppar med 16 g syre. I kopparsulfid binder 63,5 g koppar till 32 g svavel. Att dela upp massproportionerna vi har:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
Massförhållandet 2: 1 är en multipel av 4 (63,5 / 16), vilket visar att Richters lag är sant. Med denna andel erhålls SO, svavelmonoxid (32 g svavel reagerar med 16 g syre).
Om du delar detta förhållande med två får du 1: 1. Återigen är det nu en multipel av 4 eller 2, och därför handlar det om SOtvå, svaveldioxid (32 g svavel reagerar med 32 g syre).
Järnsulfid och oxid
Järnsulfid (FeS), i vilken 32 g svavel kombineras med 56 g järn, reageras med järnoxid (FeO), i vilket 16 g syre kombineras med 56 g järn. Denna artikel fungerar som referens.
I de reagerande föreningarna FeS och FeO finns svavel (S) och syre (O) i förhållande till järn (Fe) i förhållandet 2: 1. I svaveloxid (SO) kombineras 32 g svavel med 16 g syre, så att svavel och syre är i förhållandet 2: 1.
Detta indikerar att lagen om ömsesidiga proportioner eller Richters lag är uppfylld.
Förhållandet som finns mellan svavel och syre i svaveloxid (2: 1) kan exempelvis användas för att beräkna hur mycket syre som reagerar med 15 g svavel.
g syre = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Referenser
- Foist L. (2019). Lag om ömsesidigt andel: definition och exempel. Studie. Återställd från: study.com
- Cyberuppgifter. (2016, 9 februari). Lag om ömsesidiga proportioner eller Richter-Wenzel. Återställd från: cibertareas.infol
- Wikipedia. (2018). Lag av ömsesidiga proportioner. Återställd från: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter och lagen om ömsesidiga proportioner.-II, Vetenskapsannaler, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18 juni 2015). Lag av ömsesidiga proportioner. Kemi Libretexts. Återställd från: chem.libretexts.org
- Omdefiniera kunskap. (29 juli 2017). Lag av ömsesidiga proportioner. Återställd från: hemantmore.org.in

Ingen har kommenterat den här artikeln än.