
Definition av atommassa, typer, hur man beräknar den, exempel

De atomisk massa är mängden materia som finns i en atom, som kan uttryckas i vanliga fysiska enheter eller i atommasseenheter (uma eller u). En atom är tom i det mesta av sin struktur; elektroner som sprids i områden som kallas orbitaler, där det finns en viss sannolikhet att hitta dem, och deras kärna.
Protoner och neutroner finns i atomens kärna; den förra med positiva laddningar, medan den senare med neutrala laddningar. Dessa två subatomära partiklar har en massa som är mycket större än elektronens; Därför styrs en atoms massa av dess kärna och inte av vakuumet eller elektronerna.
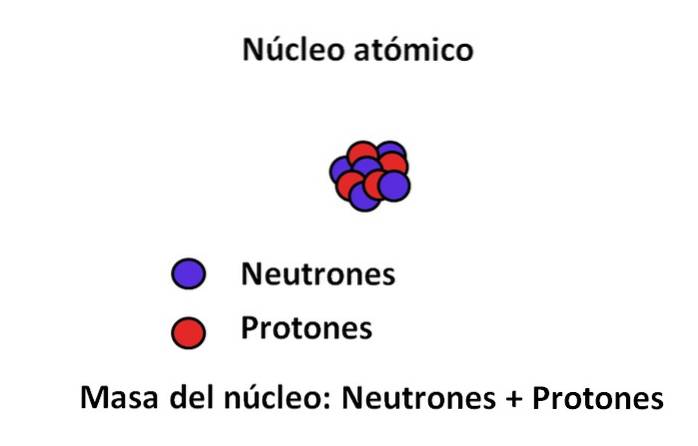
Massan av en elektron är ungefär 9,110-31 kg, medan den för protonen 1,67 · 10-27 kg, massförhållandet är 1 800; det vill säga en proton "väger" 1 800 gånger mer än en elektron. På samma sätt händer detsamma med massorna av neutronen och elektronen. Det är därför elektronens massbidrag för vanliga ändamål anses vara försumbar..
På grund av detta antas det ofta att atomens massa, eller atommassan, bara beror på massan av kärnan; som i sin tur består av summan av neutronerna och protonerna. Två begrepp framgår av detta resonemang: massantal och atommassa, båda nära besläktade..
Det finns så mycket "vakuum" i atomerna, och eftersom deras massa nästan helt är en funktion av kärnan, kan det förväntas att den senare är utomordentligt tät..
Om vi tar bort detta tomrum från någon kropp eller föremål, skulle dess dimensioner minska drastiskt. Om vi skulle kunna bygga ett litet föremål baserat på atomkärnor (utan elektroner) skulle det ha en massa på miljoner ton..
Å andra sidan hjälper atommassorna att skilja olika atomer av samma element; det här är isotoperna. Eftersom det finns isotoper som är rikligare än andra, måste ett genomsnitt av atommassorna beräknas för ett givet element; genomsnitt som kan variera från planet till planet eller från en geografisk region till en annan.
Artikelindex
- 1 Definition och koncept
- 1.1 Atommasseenhet
- 1.2 Ekvivalens i gram
- 2 Genomsnittlig atommassa
- 2.1 Exempel
- 3 Absolut atommassa
- 4 Relativ atommassa
- 5 Hur man beräknar atommassa
- 6 Exempel
- 6.1 Kol
- 6.2 Natrium
- 6.3 Syre
- 6.4 Kväve
- 6.5 Klor
- 6.6 Dysprosium
- 7 Referenser
Definition och koncept
Per definition är atommassan summan av massorna av dess protoner och neutroner uttryckta med uma eller u. Det resulterande numret (även ibland kallat massnummer) placeras måttlöst i det övre vänstra hörnet i notationen som används för nuklider. Till exempel för elementet femtonX dess atommassa är 15uma eller 15u.
Atommassan kan inte berätta mycket om den sanna identiteten för detta element X. I stället används atomnumret, vilket motsvarar protonerna i kärnan av X. Om detta tal är 7, kommer skillnaden (15-7) att vara lika med 8; det vill säga X har 7 protoner och 8 neutroner, vars summa är 15.
När vi återvänder till bilden har kärnan 5 neutroner och 4 protoner, så dess massnummer är 9; och i sin tur 9 amu är dess atommassa. Genom att ha 4 protoner och konsultera det periodiska systemet kan man se att denna kärna motsvarar den hos elementet beryllium, Be (eller 9Vara).
Atommassanhet
Atomer är för små för att kunna mäta sina massor med konventionella metoder eller vanliga balanser. Det är av denna anledning som uma, u eller Da (färgblind) uppfanns. Dessa enheter utformade för atomer gör att du kan få en uppfattning om hur massiva atomerna i ett element är i förhållande till varandra..
Men vad representerar en amu exakt? Det måste finnas en referens som gör det möjligt att upprätta massförhållanden. För detta användes atomen som referens 12C, som är den vanligaste och stabilaste isotopen för kol. Med 6 protoner (dess atomnummer Z) och 6 neutroner är dess atommassa därför 12.
Antagandet görs att protoner och neutroner har samma massor, så att var och en bidrar med 1 amu. Atommasseenheten definieras sedan som en tolfte (1/12) av massan av en kol-12-atom; detta är massan av en proton eller neutron.
Ekvivalens i gram
Och nu uppstår följande fråga: hur många gram motsvarar 1 amu? Eftersom det först inte fanns tillräckligt avancerade tekniker för att mäta det, var kemister tvungna att nöja sig med att uttrycka alla massor med amu; detta var dock en fördel och inte en nackdel.
Varför? Eftersom subatomära partiklar är så små måste deras massa, uttryckt i gram, ha varit lika liten. Faktum är att 1 amu är lika med 1.6605 · 10-24 gram. Dessutom, med användning av begreppet mol, var det inte ett problem att bearbeta massorna av elementen och deras isotoper med amu med vetskap om att sådana enheter kunde modifieras till g / mol.
Till exempel, gå tillbaka till femtonX och 9Var, vi har att deras atommassor är 15 amu respektive 9 amu. Eftersom dessa enheter är så små och inte direkt berättar hur mycket materia man måste "väga" för att manipulera dem, förvandlas de till sina respektive molmassor: 15 g / mol och 9 g / mol (introducerar begreppen mol och Avogadros antal ).
Genomsnittlig atommassa
Inte alla atomer av samma element har samma massa. Detta innebär att de måste ha fler subatomära partiklar i kärnan. Eftersom det är samma element måste atomantalet eller antalet protoner förbli konstant; därför finns det bara variation i mängden neutroner som har.
Så här framgår det av definitionen av isotoper: atomer av samma element men med olika atommassor. Till exempel består beryllium nästan helt av isotopen 9Var, med spårmängder av 10Vara. Detta exempel är dock inte särskilt användbart för att förstå begreppet genomsnittlig atommassa; vi behöver en med fler isotoper.
Exempel
Antag att elementet finns 88J, detta är den viktigaste isotopen för J med ett överflöd på 60%. J har också två andra isotoper: 86J, med ett överflöd på 20%, och 90J, med ett överflöd på 20%. Det betyder att av 100 J-atomer som vi samlar på jorden är 60 av dem 88J, och de återstående 40 en blandning av 86J och 90J.
Var och en av de tre isotoperna av J har sin egen atommassa; det vill säga deras summa av neutroner och protoner. Emellertid måste dessa massor beräknas i genomsnitt för att ha en atommassa för J till hands; här på jorden, eftersom det kan finnas andra regioner i universum där överflödet av 86J är 56% och inte 60%.
För att beräkna den genomsnittliga atommassan av J måste det viktade genomsnittet av massorna av dess isotoper erhållas; med hänsyn till procentandelen överflöd för var och en av dem. Således har vi:
Genomsnittlig massa (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Det vill säga den genomsnittliga atommassan (även känd som atomvikten) för J är 87,2 amu. Under tiden är dess molära massa 87,2 g / mol. Observera att 87.2 är närmare 88 än 86, och det är också avlägset från 90.
Absolut atommassa
Den absoluta atommassan är atommassan uttryckt i gram. Med utgångspunkt från exemplet med det hypotetiska elementet J kan vi beräkna dess absoluta atommassa (genomsnittet) med vetskap om att varje amu motsvarar 1.6605 · 10-24 gram:
Absolut atommassa (J) = 87,2 amu * (1,6605 · 10-24 g / am)
= 1 447956 10-22 g / atom J
Detta innebär att J-atomerna i genomsnitt har en absolut massa av 1.447956 · 10-22 g.
Relativ atommassa
Den relativa atommassan är numeriskt identisk med den genomsnittliga atommassan för ett givet element; Men till skillnad från den andra saknar den första enhet. Därför är den dimensionell. Till exempel är den genomsnittliga atommassan för beryllium 9,012182 u; medan dess relativa atommassa helt enkelt är 9.012182.
Det är därför som dessa begrepp ibland misstolkas som synonymer, eftersom de är mycket lika och skillnaderna mellan dem är subtila. Men vad är dessa massor i förhållande till? I förhållande till en tolfte del av massan av 12C.
Således betyder ett element med en relativ atommassa på 77 att det har en massa 77 gånger större än 1/12 av 12C.
De som har tittat på elementen i det periodiska systemet kommer att se att deras massor är relativt uttryckta. De har inte enheter av amu, och det tolkas som: järn har en atommassa på 55846, vilket innebär att det är 55846 gånger mer massa än massan av 1/12 av 12C, och som också kan uttryckas som 55,846 amu eller 55,846 g / mol.
Hur man beräknar atommassa
Matematiskt gavs ett exempel på hur man beräknar det med exemplet med element J. I allmänna termer måste den viktade genomsnittliga formeln tillämpas, vilket skulle vara:
P = Σ (isotop atommassa) (överflöd i decimaler)
Med andra ord, med atommassorna (neutroner + protoner) för varje isotop (normalt naturligt) för ett visst element, såväl som deras respektive markbundna överflöd (eller vilken region som helst), kan nämnda viktade medel beräknas..
Och varför inte bara det aritmetiska genomsnittet? Till exempel är den genomsnittliga atommassan av J 87,2 amu. Om vi beräknar denna massa igen men aritmetiskt har vi:
Genomsnittlig massa (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Observera att det finns en viktig skillnad mellan 88 och 87.2. Detta beror på att det aritmetiska genomsnittet antar att överflödet av alla isotoper är detsamma; Eftersom det finns tre isotoper av J, bör var och en ha ett överflöd på 100/3 (33,33%). Men så är det inte i verkligheten: det finns mycket rikligare isotoper än andra.
Det är därför det vägda genomsnittet beräknas, eftersom det tar hänsyn till hur riklig en isotop är i förhållande till en annan..
Exempel
Kol
För att beräkna den genomsnittliga atommassan av kol behöver vi dess naturliga isotoper med deras respektive överflöd. När det gäller kol är dessa: 12C (98,89%) och 13C (1,11%). Deras relativa atommassa är 12 respektive 13, vilket i sin tur är lika med 12 amu och 13 amu. Lösning:
Genomsnittlig atommassa (C) = (12 amu) (0,9889) + (13 amu) (0,0111)
= 12,0111 amu
Därför är massan av en kolatom i genomsnitt 12,01 amu. Eftersom det finns spårmängder av 14C, har nästan inget inflytande på detta genomsnitt.
Natrium
Alla markbundna natriumatomer består av isotopen 2. 3Na, så dess överflöd är 100%. Det är därför som i vanliga beräkningar kan dess massa antas vara helt enkelt 23 amu eller 23 g / mol. Den exakta massan är dock 22,98976928 amu.
Syre
De tre isotoperna av syre med deras respektive överflöd är: 16O (99,762%), 17O (0,038%) och 18O (0,2%). Vi har allt för att beräkna dess genomsnittliga atommassa:
Genomsnittlig atommassa (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16,00438 amu
Även om den rapporterade exakta massan faktiskt är 15.9994 amu.
Kväve
Upprepa samma steg med syre som vi har: 14N (99,634%) och femtonN (0,366%). Sedan:
Genomsnittlig atommassa (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14,00366 amu
Observera att den rapporterade massan för kväve är 14,0067 amu, lite högre än den vi beräknade.
Klor
Klorisotoperna med deras respektive överflöd är: 35Cl (75,77%) och 37Cl (24,23%). Beräkning av dess genomsnittliga atommassa har vi:
Genomsnittlig atommassa (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Mycket lik den rapporterade (35 453 amu).
Dysprosium
Och slutligen kommer den genomsnittliga massan av ett element med många naturliga isotoper att beräknas: dysprosium. Dessa och med deras respektive överflöd är: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) och 164Dy (28,18%).
Vi fortsätter som i föregående exempel för att beräkna atommassan för denna metall:
Genomsnittlig atommassa (Dy) = (156 amu) (0,0006%) + (158 amu) (0,0010) + (160 amu) (0,0234) + (161 amu) (0,1891) + (162 amu) (0,2551) + (163 amu) (0.2490) + (164 amu) (0.2818)
= 162,5691 amu
Den rapporterade massan är 162500 amu. Observera att detta genomsnitt ligger mellan 162 och 163, eftersom isotoperna 156Dy, 158Dy och 160Dy är få rikliga; medan de som dominerar är 162Dy, 163Dy och 164Dy.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2019). Atomisk massa. Återställd från: en.wikipedia.org
- Christopher Masi. (s.f.). Atomic Mass. Återställd från: wsc.mass.edu
- Natalie Wolchover. (12 september 2017). Hur väger du ett atom? Live Science. Återställd från: livescience.com
- Kemi LibreTexts. (05 juni 2019). Beräkning av atommassor. Återställd från: chem.libretexts.orgs
- Edward Wichers och H. Steffen Peiser. (15 december 2017). Atomvikt. Encyclopædia Britannica. Återställd från: britannica.com


Ingen har kommenterat den här artikeln än.