
Molmassa hur man beräknar den, exempel och lösta övningar
De molär massa är en intensiv egenskap hos materia som relaterar begreppet en mol till massmätningar. Eftersom det är mer kortfattat är det massan som motsvarar en mol substans; det vill säga vad ett Avogadro-nummer "väger", (6.022 · 102. 3) av bestämda partiklar.
En mol av vilken substans som helst kommer att innehålla samma antal partiklar (joner, molekyler, atomer etc.); emellertid kommer dess massa att variera eftersom dess molekylära dimensioner definieras av antalet atomer och de isotoper som utgör dess struktur. Ju mer massiv atomen eller molekylen är, desto större är dess molära massa..
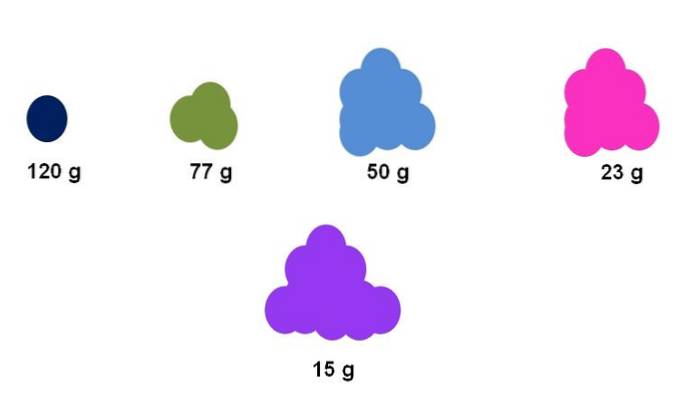
Antag till exempel att exakt en mol samlas för fem olika föreningar (toppbild). Med hjälp av en balans har massan för varje kluster, uttryckt nedan, uppmätts. Denna massa motsvarar molmassan. Av alla har den lila föreningen de lättaste partiklarna, medan den mörkblå föreningen har de tyngsta partiklarna..
Observera att en generaliserad och överdriven trend visas: ju högre molmassa desto mindre är mängden prov som måste placeras på balansen. Emellertid är denna volym av materia också mycket beroende av tillståndet för aggregering av varje förening och dess densitet..
Artikelindex
- 1 Hur beräknar man molmassan?
- 1.1 Definition
- 1.2 Element
- 1.3 Föreningar
- 2 Exempel
- 3 Lösta övningar
- 3.1 Övning 1
- 3.2 Övning 2
- 3.3 Övning 3
- 4 Referenser
Hur beräknar man molmassan?

Definition
Molmassa kan beräknas utifrån dess definition: massmassa per mol ämne:
M = gram ämne / mol ämne
I själva verket är g / mol den enhet i vilken molmassa vanligtvis uttrycks, tillsammans med kg / mol. Således, om vi vet hur många mol vi har av en förening eller ett element och vi väger det, kommer vi direkt till dess molmassa genom att använda en enkel uppdelning.
Element
Molmassa gäller inte bara föreningar utan även för element. Begreppet mullvad diskriminerar inte alls. Därför, med hjälp av ett periodiskt system, lokaliserar vi de relativa atommassorna för ett intressant element, och vi multiplicerar dess värde med 1 g / mol; det här är Avogadros konstant, MELLER.
Till exempel är den relativa atommassan för strontium 87,62. Om vi vill ha sin atommassa skulle den vara 87,62 amu; men om det vi letar efter är dess molära massa, så blir den 87,62 g / mol (87,62 · 1g / mol). Och därmed erhålls molmassorna för alla andra element på samma sätt, utan att ens behöva utföra multiplikationen..
Föreningar
Molmassan för en förening är inget annat än summan av de relativa atommassorna för dess atomer multiplicerat med MELLER.
Till exempel kan vattenmolekylen, HtvåEller, den har tre atomer: två väte och ett syre. De relativa atommassorna för H och O är 1,008 respektive 15,999. Således lägger vi till deras massor genom att multiplicera med antalet atomer som finns i föreningens molekyl:
2H (1,008) = 2,016
1 O (15.999) = 15.999
M(HtvåO) = (2 016 + 15 999) 1 g / mol = 18 015 g / mol
Det är en ganska vanlig praxis att utelämna MELLER i slutet:
M(HtvåO) = (2 016 + 15 999) = 18 015 g / mol
Molmassa förstås ha enheter g / mol.
Exempel
En av de mest kända molära massorna har just nämnts: den för vatten, 18 g / mol. De som är bekanta med dessa beräkningar når en punkt där de kan memorera några molära massor utan att behöva leta efter dem eller beräkna dem som gjordes ovan. Några av dessa molära massor, som fungerar som exempel, är följande:
-ELLERtvå: 32 g / mol
-Ntvå: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-COtvå: 44 g / mol
-HCl: 36,5 g / mol
-HtvåSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Observera att de angivna värdena är rundade. För mer exakta ändamål bör molmassorna uttryckas till mer decimaler och beräknas med de beräknade och exakta relativa atommassorna.
Lösta övningar
Övning 1
Med analytiska metoder uppskattades att en lösning av ett prov innehåller 0,0267 mol av en analyt D. Det är också känt att dess massa motsvarar 14% av ett prov vars totala massa är 76 gram. Beräkna molmassan för den förmodade analyten D..
Vi måste bestämma massan av D som är upplöst i lösningen. Vi fortsätter:
Massa (D) = 76 g 0,14 = 10,64 g D
Det vill säga, vi beräknar 14% av de 76 gram av provet, vilket motsvarar gram analyt D. Då slutligen tillämpar vi definitionen av molmassa, eftersom vi har tillräckligt med data för att beräkna den:
M(D) = 10,64 g D / 0,0267 mol D
= 398,50 g / mol
Vilket översätts som: en mol (6.022102. 3) av Y-molekyler har en massa lika med 398,50 gram. Tack vare detta värde kan vi veta hur mycket av Y vi vill väga på vikten om vi till exempel vill förbereda en lösning med en molkoncentration på 5 · 10-3 M; d.v.s. lösa upp 0.1993 gram Y i en liter lösningsmedel:
5 10-3 (mol / L) · (398,50 g / mol) = 0,1999 g Y
Övning 2
Beräkna molmassan av citronsyra med vetskap om att dess molekylformel är C6H8ELLER7.
Samma formel C6H8ELLER7 Det underlättar förståelsen av beräkningen, eftersom den berättar omedelbart antalet C-, H- och O-atomer som finns i citronsyra. Därför upprepar vi samma steg för vattnet:
6 C · (12,0107) = 72,0642
8 H (1008) = 8064
7 O (15.999) = 111.993
M(citronsyra) = 72,0642 + 8,064 + 111,993
= 192,1212 g / mol
Övning 3
Beräkna molmassan av kopparsulfatpentahydrat, CuSO45HtvåELLER.
Vi vet från tidigare att molmassan för vatten är 18.015 g / mol. Detta hjälper oss att förenkla beräkningarna, eftersom vi utelämnar det för tillfället och fokuserar på det vattenfria saltet CuSO4.
Vi har att de relativa atommassorna av koppar och svavel är 63,546 respektive 32,065. Med dessa data fortsätter vi på samma sätt som med övning 2:
1 Cu (63,546) = 63,546
1 S (32 065) = 32 065
4 O (15.999) = 63.996
M(CuSO4) = 63,546 + 32,065 + 63,996
= 159,607 g / mol
Men vi är intresserade av den molära massan av det pentahydrerade saltet, inte det vattenfria. För att göra detta måste vi lägga till motsvarande massa vatten till resultatet:
5 timmartvåO = 5 (18 015) = 90 075
M(CuSO45HtvåO) = 159,607 + 90,075
= 249,682 g / mol
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2020). Molmassa. Återställd från: en.wikipedia.org
- Nissa Garcia. (2020). Vad är molarmassa? Definition, formel och exempel. Studie. Återställd från: study.com
- Dr. Kristy M. Bailey. (s.f.). Stoichiometry Tutorial
Finding Molar Mass. Återställd från: occc.edu - Helmenstine, Anne Marie, Ph.D. (02 december 2019). Molar Mass Exempel Problem. Återställd från: thoughtco.com

Ingen har kommenterat den här artikeln än.