
SIM-medium grund, förberedelse och användningsområden
De halv SIM är en halvfast och differentiell agar, speciellt utformad för att hjälpa till att identifiera vissa bakterier, huvudsakligen av Enterobacteriaceae-familjen. Den består av triptein, pepton, järnsulfat, ammoniumsulfat, natriumtiosulfat och agar..
Detta medium möjliggör genomförande av tre viktiga tester: produktion av vätesulfid (HtvåS), indolbildning och rörlighet, därav kommer akronymen SIM från. På grund av dess stora användbarhet kan det inte saknas i ett bakteriologilaboratorium.

Till skillnad från andra medier måste den vara halvfast för att vissa bakteriers rörelsekapacitet ska kunna detekteras. I detta avseende fungerar detta test mycket bra för Enterobacteriaceae, men inte i icke-jäsning av gramnegativa stavar, där det föredras att använda andra metoder, såsom hängande droppe..
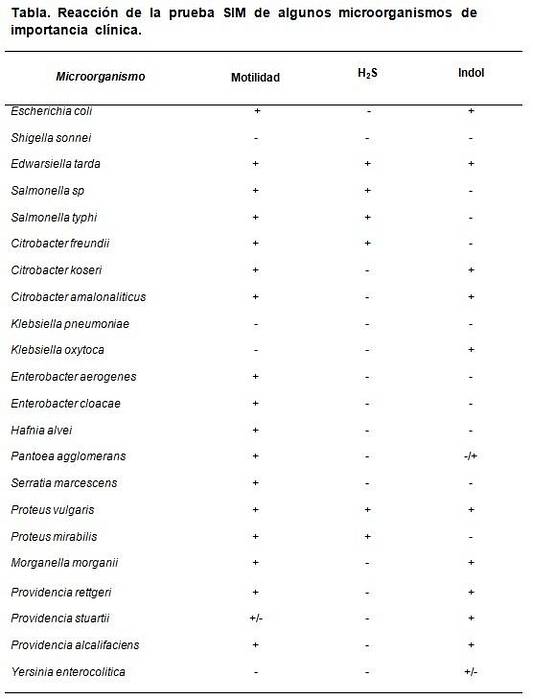
SIM-mediet gör det möjligt att särskilja vissa specifika egenskaper som kännetecknar vissa bakterier i förhållande till andra. Till exempel Escherichia coli kännetecknas av att vara HtvåS (-), indol (+) och rörlighet (+), medan Proteus mirabilis det är HtvåS (+), indol (-), rörlighet (+).
Artikelindex
- 1 Motivering
- 1.1 Strömkälla
- 1.2 Produktion av vätesulfid
- 1.3 Bildning av indol
- 1.4 Rörlighet
- 2 Förberedelse
- 2.1 Medium SIM
- 2.2 Kovacs reagens
- 2.3 Erlichs reagens
- 3 användningsområden
- 3.1 Sådd
- 4 Kvalitetskontroll
- 5 Begränsningar
- 6 Referenser
Grund
Det är ett odlingsmedium som anses vara differentiellt, eftersom dess användning skiljer mellan mikroorganismer som kan producera vätesulfid från de som inte gör det; Det lyfter också fram de som bildar indol från tryptofan från de som inte bildar det och skiljer slutligen de rörliga bakterierna från de orörliga..
Kraftkälla
Som alla odlingsmedier har den element som ger nödvändiga näringsämnen så att icke-krävande mikroorganismer kan utvecklas. Dessa element representeras av peptoner och triptein.
Utvecklingen av mikroorganismen i mediet är väsentlig för att kunna observera närvaron eller frånvaron av de egenskaper som detta medium utvärderar..
Produktion av vätesulfid
Bokstaven S i akronymen SIM hänvisar till produktionen av vätesulfid (HtvåS). Bakterier som kan bilda vätesulfid tar upp svavlet från natriumtiosulfat.
När HtvåS-färglös gas- reagerar detta med järnsaltet som finns i mediet och bildar järnsulfid, tydligt synlig (svart fällning). Bakterier som inte bildar HtvåJa, lämna mitten av originalfärgen (beige).
Närvaron av den svarta fällningen kan hindra tolkningen av rörlighet. Det är emellertid känt att de flesta H-producerande EnterobacteriaceaetvåS är positiv rörlighet, såsom Salmonella, Proteus och Citrobacter. Dessutom antyder den svarta fällningen som täcker nästan hela mediet positiv rörlighet.
Indolbildning
Den andra bokstaven i akronymen SIM är "I", vilket representerar bildandet av indol.
I denna mening fyller triptein, förutom att vara en näringskälla, en annan grundläggande funktion. Denna pepton är rik på en aminosyra som kallas tryptofan, därför kan den visa de bakterier som producerar tryptofanas.
Detta enzym är ansvarigt för klyvning av aminosyran tryptofan, med därav följande bildning av indol (färglös substans), pyruvsyra och ammonium.
Det är därför, för att demonstrera denna reaktion, är det nödvändigt att tillsätta ett avslöjande ämne (Ehrlichs reagens eller Kovacs reagens). Antingen reagerar med indol och bildar en röd-fuchsia-ringformad substans på ytan av agaren. Om fuchsia-ringen dyker upp tolkas indolprovet som positivt.
Bakterier som inte har detta enzym bildar inte ringen och det tolkas som ett negativt indoltest.
Det är viktigt att notera att indoltestet ska vara det sista som ska tolkas, eftersom när reagenset tillsätts blir mediet grumligt, vilket gör det svårt att visualisera rörlighet..
Rörlighet
Slutligen betyder bokstaven "M" i ordet SIM rörlighet. För att kunna utvärdera rörlighet är detta medium strategiskt halvfast, eftersom denna egenskap är väsentlig för att kunna observera om det finns bakterierörelse eller inte. Bakterier som har flagella är de som ger detta positiva test.
Ett positivt test är uppenbart när grumlighet observeras, både i den ursprungliga ympningen och runt den. Icke-rörliga bakterier utvecklas endast i vägen för den ursprungliga ympningen.
Förberedelse
Medium SIM
Väg 30 g av det uttorkade mediet och lös upp det i en liter destillerat vatten. Blandningen får stå i 5 minuter och upphettas sedan till kokning och omrörs ofta tills den är helt upplöst..
Fördela blandningen i provrör med bomullslock och autoklav vid 121 ° C i 15 minuter. Ta bort rörhyllan från autoklaven och låt den stelna i vertikalt läge så att mediet är i form av ett block.
För att bevara den förvaras den i kylskåpet tills den används. Det beredda mediet måste ha ett slutligt pH på 7,3 ± 0,2.
När mediet inokuleras måste det ha rumstemperatur. Den mellersta färgen är beige.
Kovacs reagens
Mät 150 ml amyl eller isoamyl eller butylalkohol. (Använd en av de tre nämnda).
Lös upp 10 g p-dimetylaminobensaldehyd. Tillsätt sedan långsamt 50 ml koncentrerad saltsyra.
Det färdiga reagenset är färglöst eller ljusgult. Den ska förvaras i en gul flaska och förvaras i kylskåp. Använd inte om den får en mörkbrun färg; som indikerar att den är skadad. Detta reagens föredras när det gäller Enterobacteriaceae.
Erlichs reagens
Väg upp 2 g p-dimetylaminobensaldehyd och lös upp i 190 ml absolut etylalkohol och blanda långsamt med 40 ml koncentrerad saltsyra. Förvara Kovacs reagens på samma sätt. Ehrlichs reagens används mer för icke-jäsning och anaeroba bakterier.
Applikationer
SIM-medium används mycket i bakteriologilaboratorier. Det har fördelen att tre väsentliga egenskaper vid identifieringen av Enterobacteriaceae kan observeras i samma rör..
Sådd
Det korrekta sättet att så detta medium är att använda nålen, med vilken en del av den rena kolonin som ska studeras tas och förs in vertikalt i mitten av mediet. Ett enda utfall bör utföras. Punkteringen ska inte nå botten av röret, det rätta är att bara täcka två tredjedelar av djupet.
Det rekommenderas inte att upprepa inokulatet, eftersom detta kan leda till falska tolkningar av positiv rörlighet. Det ympade mediet inkuberas aerobt vid 37 ° C under 24 timmar..
Efter tiden observeras om det fanns produktion av H eller intetvåS och rörlighet läses. Slutligen avslöjas indolen, tillsätt 3 till 4 droppar av Ehrlich eller Kovacs reagens, blanda försiktigt och tolka.
QA
Som en sterilitetskontroll inkuberas ett eller två rör utan ympning i en ugn vid 37 ° C i 24 timmar. Det förväntas att det efter denna tid inte kommer att ske någon tillväxt eller färgförändring.
Som kvalitetskontroll kan certifierade kända stammar användas, såsom: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
De förväntade resultaten är: Escherichia coli HtvåS negativ, indol och positiv rörlighet, Enterobacter aerogenes bara positiv rörlighet, Salmonella typhimurium HtvåS och positiv rörlighet, med negativ indol. Proteus vulgaris alla positiva, medan Klebsiella pneumoniae Y Shigella sonnei alla negativa.
Begränsningar
-Några stammar av Morganella morganii, Bland andra stammar kan de producera ett brunt pigment i detta medium på grund av produktionen av melanin, detta bör inte förväxlas med fällningen av järnsulfid. Hos oerfarna proffs kan denna situation generera falska positiva tolkningar av H-testet.tvåS.
-Stränga aeroba bakterier kommer bara att växa på rörets yta, vilket gör det svårt att tolka rörlighet.
Referenser
- BD Laboratories. BBL SIM Medium. 2008. Tillgänglig på: bd.com
- Neogen Laboratories. SIM Medium. Finns på: livsmedelssäkerhet
- Difco Francisco Soria Melguizo. SIM Medium. 2009. Tillgänglig på: http://f-soria.es
- Brizuela-Lab Laboratory. Medium SIM. Tillgänglig på: .brizuela-lab.com
- Britannia Laboratories. Medium SIM. 2015.Tillgänglig på: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan Redaktionellt Panamericana S.A. Argentina.



Ingen har kommenterat den här artikeln än.