
Karaktäristiska mikrofilament, struktur, funktioner, patologi
De mikrofilament eller aktinfilament, är en av de tre grundläggande komponenterna i cytoskelettet i eukaryota celler (mikrofilament, mikrotubuli och mellanliggande filament) och består av små filament av ett protein som kallas aktin (aktinpolymerer).
I eukaryoter är generna som kodar för aktinmikrofilament mycket konserverade i alla organismer, varför de ofta används som molekylära markörer för studier av olika slag.

Mikrofilament distribueras i hela cytosolen, men är särskilt rikliga i den region som ligger bakom plasmamembranet, där de bildar ett komplext nätverk och associeras med andra speciella proteiner för att bilda cytoskelettet..
Mikrofilamentnätverk i cytoplasman hos däggdjursceller kodas av två av de sex gener som beskrivs för aktin, vilka är involverade i mikrofilamentdynamik och är till och med mycket viktiga vid stamcellsdifferentiering.
Många författare är överens om att mikrofilament är de mest mångsidiga, mångsidiga och viktigaste proteinerna i cytoskelettet hos de flesta eukaryota celler, och det är viktigt att komma ihåg att dessa inte finns i prokaryota mikroorganismer..
I den här typen av celler finns å andra sidan filament som är homologa med mikrofilament, men som består av ett annat protein: MreB-proteinet..
För närvarande tros den gen som kodar för detta protein vara en möjlig förfädergen för eukaryotiskt aktin. Sekvenshomologin för aminosyrorna som utgör MreB-proteinet är emellertid endast 15% med avseende på aktinsekvensen.
Eftersom de är en grundläggande del av cytoskelettet kan alla fenotypiska defekter i både mikrotubuli och mellanliggande filament och aktinmikrofilament (cytoskelett) orsaka olika cellulära och systemiska patologier.
Artikelindex
- 1 Egenskaper och struktur
- 1.1 Organisation
- 2 Hur bildas aktinfilament?
- 2.1 Reglering
- 3 funktioner
- 3.1 Exempel på funktioner i levern
- 4 Relaterade patologier
- 5 Referenser
Egenskaper och struktur
Mikrofilament består av proteinmonomerer av aktinfamiljen, som är mycket rikliga kontraktila proteiner i eukaryota celler, eftersom de också deltar i muskelkontraktion..
Dessa trådar har en diameter mellan 5 och 7 nm, så de är också kända som tunna trådar och består av två former av aktin: den globulära formen (G-aktin) och den trådformiga formen (F-aktin)..
Proteinerna som deltar i cytoskelettet är kända som γ- och β-aktiner, medan de som deltar i sammandragning vanligtvis är α-aktiner..
Andelen globulärt aktin och trådformigt aktin i cytosolen beror på cellulära behov, eftersom mikrofilament är mycket varierande och mångsidiga strukturer, som ständigt växer och förkortas genom polymerisation och depolymerisation..
G-aktin är ett litet globulärt protein, som består av nästan 400 aminosyror och med en molekylvikt på cirka 43 kDa.
G-aktinmonomererna som utgör mikrofilamenten är ordnade i form av en spiralformad sträng, eftersom var och en genomgår en vridning när den associeras med nästa.
G-aktin associeras med en molekyl Ca2 + och en annan av ATP, som stabiliserar dess globulära form; medan F-aktin erhålls efter hydrolys av terminal fosfat av ATP-molekylen till G-aktin, vilket bidrar till polymerisation.
Organisation
Aktinfilament kan organiseras i "buntar" eller "nätverk" som har olika funktioner i celler. Buntarna bildar parallella strukturer länkade av ganska styva tvärbryggor.
Nätverk däremot är lösare strukturer, som tredimensionella nät med egenskaperna hos halvfasta geler..
Det finns många proteiner som är associerade med aktinfilament eller mikrofilament och kallas ABP (från engelska aktinbindande proteiner), som har specifika platser för det.
Många av dessa proteiner tillåter mikrofilament att interagera med de andra två komponenterna i cytoskelettet: mikrotubuli och mellanliggande filament, liksom med de andra komponenterna i plasmamembranets inre yta..
Andra proteiner som mikrofilament interagerar med inkluderar nukleära laminer och spektrin (i röda blodkroppar).
Hur bildas aktinfilament?
Eftersom globulära aktinmonomerer alltid binder på samma sätt, orienterade i samma riktning, har mikrofilament en definierad polaritet med två ändar: en "mer" och en "mindre"..
Polariteten hos dessa trådar är mycket viktig, eftersom de växer betydligt snabbare i sin positiva ände, där de nya G-aktinmonomererna läggs till..

Det första som sker under polymerisationen av aktinfilament är en process som kallas "kärnbildning", som består av associering av tre monomerer av proteinet.
Nya monomerer läggs till denna trimer i båda ändar, så att filamentet växer. G-aktinmonomerer kan hydrolysera ATP med varje bindning, vilket har konsekvenser för polymerisationshastigheten, eftersom aktin-ATP-enheter dissocierar med större svårighet än aktin-ADP-delar..
ATP är inte nödvändigt för polymerisation och hydrolysens specifika roll har ännu inte belysts..
Vissa författare anser att eftersom aktinpolymerisationshändelser snabbt är reversibla kan ATP associerat med dessa processer representera upp till 40% av den totala cellulära omsättningen för denna energimolekyl..
Förordning
Både polymerisationen av aktinfilament och deras depolymerisation är processer som är starkt reglerade av en serie specifika proteiner, som ansvarar för omformningen av filamenten..
Ett exempel på proteiner som reglerar depolymerisering är aktindepolymerisationsfaktorn cofilin. Ett annat protein, profilin, har en motsatt funktion, eftersom det stimulerar associering av monomerer (genom att stimulera utbytet av ADP mot ATP).
Funktioner
Mikrofilament interagerar med myosinfilament som är associerade med transmembranproteiner som har en domän i cytosolen och en annan i cellens yttre del och därmed deltar i processerna för cellmobilitet.
Dessa mikrofilament associerade med plasmamembranet förmedlar olika cellulära svar på olika klasser av stimuli. Till exempel drivs cellvidhäftning i epitelvävnader av transmembranproteiner som kallas kadheriner, som interagerar med mikrofilament för att rekrytera svarsfaktorer..
Aktinfilament interagerar med mellanliggande filament för att orsaka att extracellulära stimuli överförs till viktiga platser såsom ribosomer och kromosomer i kärnan..
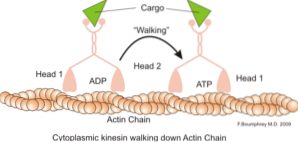
En klassisk och mycket studerad funktion av mikrofilament är deras förmåga att bilda "broar", "skenor" eller "motorvägar" för förflyttningen av motorproteinet myosin I, som kan ladda transportvesiklar från organeller till membranplasmatiskt i sekretet vägar.
Mikrofilament interagerar också med myosin II för att fastställa den sammandragna ringen som bildas under cytokinese, just under det sista steget av celldelning där cytosolen separeras från stam- och dotterceller..
I allmänhet modulerar F-aktin-mikrofilament fördelningen av vissa organeller såsom Golgi-komplexet, endoplasmatiskt retikulum och mitokondrier. Dessutom deltar de också i den rumsliga positioneringen av mRNA så att de läses av ribosomer..
Hela celluppsättningen av mikrofilament, speciellt de som är nära besläktade med plasmamembranet, deltar i bildandet av de böljande membranen hos celler som har en konstant aktiv rörelse.
De är också inblandade i bildandet av mikrovilli och andra vanliga stötar på ytan av många celler..
Exempel på funktioner i levern
Mikrofilament deltar i gallsekretionsprocessen i hepatocyter (leverceller) och även i peristaltiska rörelser (samordnad sammandragning) av leverkanalen..
De bidrar till differentieringen av plasmamembrandomäner tack vare deras associering med olika cytosoliska element och den kontroll de utövar över topografin för dessa intracellulära element..
Relaterade patologier
Det finns få sjukdomar associerade med primära defekter i strukturen eller med regulatoriska proteiner och enzymer i syntesen av mikrofilament, trots att dessa är direkt involverade i ett stort antal funktioner..
Den låga frekvensen av sjukdomar och missbildningar i mikrofilamentens primära struktur beror på det faktum att det generellt finns flera gener som kodar för både aktin och dess regulatoriska proteiner, ett fenomen som kallas "genetisk redundans".
En av de mest studerade patologierna är förglasningen av äggcellerna på deras cytoskelett, där ett avbrott i nätverket av kortikala mikrofilament observeras, liksom en depolymerisering och desorganisering av mikrotubuli i den mitotiska spindeln..
I allmänna termer orsakar denna förglasning en kromosomdispersion, eftersom den leder till en störning i komprimeringen av allt kromatin.
Cellerna som har en större organisation och andel mikrofilament i deras cytoskelett är cellerna i den strimmade muskeln, därför är de flesta patologierna associerade med en felfunktion i den kontraktila apparaten.
Defekta eller atypiska mikrofilament har också associerats med den bensjukdom som kallas Pagets sjukdom..
Referenser
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C., & Vicente-Manzanares, M. (2017). Mikrofilamentkoordinerad vidhäftningsdynamik driver enstaka cellmigrering och formar hela vävnader. F1000 Forskning, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Aktinbindande proteiner: reglering av cytoskeletala mikrofilament. Fysiologiska recensioner, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistabilitet vid synkronisering av manövrerade mikrofilament. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (red.). (2011). Principer för vävnadsteknik. Akademisk press.
- Robbins, J. (2017). Cytoskelettets sjukdomar: Desminopatierna. I kardioskeletala myopatier hos barn och unga vuxna (s. 173-192). Academic Press.



Ingen har kommenterat den här artikeln än.