
Heisenberg atommodell

Vad är Heisenbergs atommodell?
De Heisenberg atommodell (1927) introducerar osäkerhetsprincipen i elektronorbitalerna som omger atomkärnan. Den framstående tyska fysikern lade grunden för kvantmekanik för att uppskatta beteendet hos de subatomära partiklarna som utgör en atom.
Werner Heisenbergs osäkerhetsprincip tyder på att det inte är möjligt att med säkerhet veta positionen och linjär momentum för en elektron samtidigt. Samma princip gäller variablerna tid och energi; om vi har en aning om positionen för elektronen, kommer vi inte att känna elektronens linjära momentum, och vice versa.
Kort sagt, det är inte möjligt att samtidigt förutsäga värdet på båda variablerna. Ovanstående innebär inte att någon av de ovannämnda kvantiteterna inte kan vara exakt kända. Så länge det är separat finns det inget hinder för att erhålla räntevärdet.
Osäkerhet uppstår emellertid när det gäller att samtidigt känna till två konjugerade mängder, såsom position och linjär momentum, och tid tillsammans med energi..
Denna princip uppstår på grund av ett strikt teoretiskt resonemang, som den enda livskraftiga förklaringen som ger anledning till vetenskapliga observationer.
Kännetecken för Heisenberg atommodell

I mars 1927 publicerade Heisenberg sitt arbete Om det perceptuella innehållet i kinematik och kvantteoretisk mekanik, där du redogjorde för osäkerhets- eller obestämbarhetsprincipen.
Denna princip, grundläggande i den atommodell som Heisenberg föreslår, kännetecknas av följande:
- Osäkerhetsprincipen framträder som en förklaring som kompletterar de nya atomteorierna om elektroners beteende. Trots att man använder mätinstrument med hög precision och känslighet, finns det fortfarande obestämbarhet i alla experimentella test.
- På grund av osäkerhetsprincipen, när du analyserar två relaterade variabler, om du har en exakt kunskap om en av dessa, blir osäkerheten om värdet på den andra variabeln större och större..
- Elektronens momentum och position eller annan subatomär partikel kan inte mätas samtidigt.
- Förhållandet mellan båda variablerna ges av en ojämlikhet. Enligt Heisenberg är produkten av variationerna i det linjära momentet och partikelns position alltid större än kvoten mellan plankonstanten (6.62606957 (29) × 10 -3. 4 Jules x sekunder) och 4π, som beskrivs i följande matematiska uttryck:

Legenden som motsvarar detta uttryck är följande:
∆p: obestämbarhet av det linjära ögonblicket.
∆x: obestämd position.
h: Plankan är konstant.
π: nummer pi 3.14.
- Med tanke på ovanstående har osäkerhetsprodukten som en nedre gräns förhållandet h / 4π, vilket är ett konstant värde. Därför, om en av storheterna tenderar att vara noll, måste den andra öka i samma proportion.
- Detta förhållande gäller för alla par av konjugerade kanoniska mängder. Till exempel: Heisenbergs osäkerhetsprincip är perfekt tillämplig på energitidsparet, som beskrivs nedan:
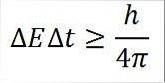
I detta uttryck:
∆E: obestämbarhet av energi.
∆t: tidsbestämning.
h: Plankan är konstant.
π: nummer pi 3.14.
- Av denna modell följer att absolut kausal determinism i konjugerade kanoniska variabler är omöjlig, eftersom man bör ha kunskap om de initiala värdena för studievariablerna för att fastställa detta samband..
- Följaktligen är Heisenberg-modellen baserad på probabilistiska formuleringar på grund av den slumpmässighet som finns mellan variablerna på subatomära nivåer..
Experimentella tester
Heisenbergs osäkerhetsprincip framträder som den enda möjliga förklaringen till de experimentella testerna som ägde rum under de första tre decennierna av 2000-talet..
Innan Heisenberg förklarade osäkerhetsprincipen föreslog de gällande föreskrifterna vid den tiden att variablerna linjär momentum, position, vinkelmoment, tid, energi, bland annat, för subatomära partiklar definierades operativt.
Detta innebar att de behandlades som om de var klassisk fysik; det vill säga ett initialt värde mättes och det slutliga värdet uppskattades enligt det förutbestämda förfarandet.
Detta innebar att man definierade ett referenssystem för mätningar, mätinstrumentet och sättet att använda instrumentet, i enlighet med den vetenskapliga metoden..
Följaktligen måste variablerna som beskrivs av subatomära partiklar bete sig på ett deterministiskt sätt. Det vill säga, dess beteende måste förutses exakt och exakt..
Varje gång ett test av denna typ genomfördes var det dock omöjligt att få det teoretiskt uppskattade värdet i mätningen..
Mätningarna förvrängdes på grund av de naturliga förhållandena i experimentet, och det erhållna resultatet var inte användbart för att berika atomteorin.
Exempel
Till exempel: om det är en fråga om att mäta en elektronhastighet och position, måste uppställningen av experimentet överväga kollisionen mellan en ljusfoton och elektronen.
Denna kollision inducerar en variation i hastigheten och den inre positionen hos elektronen, med vilken objektet för mätningen ändras av de experimentella förhållandena..
Därför uppmuntrar forskaren förekomsten av ett oundvikligt experimentfel, trots de använda instrumentens noggrannhet och precision..
Andra kvantmekaniker än klassisk mekanik
Förutom ovanstående säger Heisenbergs obestämdhetsprincip att kvantmekaniken per definition fungerar annorlunda än klassisk mekanik..
Följaktligen antas att exakt kunskap om mätningar på subatomär nivå är begränsad av den fina linjen som skiljer klassisk och kvantmekanik..
Begränsningar av Heisenberg-modellen
Trots att man förklarar subatomära partiklarnas obestämbarhet och fastställer skillnaderna mellan klassisk och kvantmekanik, upprättar Heisenbergs atommodell inte en enda ekvation för att förklara slumpmässigheten hos denna typ av fenomen..
Dessutom innebär det faktum att förhållandet upprättas genom en ojämlikhet att utbudet av möjligheter för produkten av två konjugerade kanoniska variabler är obestämt. Följaktligen är osäkerheten i subatomära processer betydande..
Artiklar av intresse
Schrödingers atommodell.
Atomic de Broglie-modellen.
Chadwick Atomic Model.
Perrins atommodell.
Thomsons atommodell.
Dalton atommodell.
Dirac Jordan atommodell.
Atommodell för Democritus.
Atommodell av Leucippus.
Bohr atommodell.
Sommerfeld atommodell.
Nuvarande atommodell.
Referenser
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Återställd från: britannica.com
- Heisenbergs osäkerhetsprincip (s.f.). Återställd från: hiru.eus
- García, J. (2012). Heisenbergs osäkerhetsprincip. Återställd från: hiberus.com
- Atomic modeller (s.f.). Nationella autonoma universitetet i Mexiko. Mexiko DF, Mexiko. Återställd från: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.). Återställd från: the-history-of-the-atom.wikispaces.com
- Wikipedia, The Free Encyclopedia (2018). Plankan är konstant. Återställd från: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2018). Heisenbergs obestämdhet. Återställd från: es.wikipedia.org



Ingen har kommenterat den här artikeln än.